20.(12分)对一个化学反应的研究需要从反应条件、限度、速率、定量关系等因素进行
综合分析,下列是关于化学反应的系列研究,请根据相关信息回答问题。
(1)关于反应物之间的定量关系的研究:
已知反应:Br2+2Fe2+== 2Br-+2Fe3+ ,向10 mL 0.1 mol·L–1的FeBr2溶液中通入0.001 mol Cl2,该反应的离子方程式为: ▲
(2)关于反应速率、限度的研究:
①已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,在氯化镁溶液中加入一定量的烧碱,测得pH=13.0,则此温度下残留在溶液中的c(Mg2+)= ▲ 。
②科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.10 mol水蒸气,发生反应:
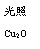
2H2O(g)  2H2(g)+O2(g) △H=+484 kJ·mol-1
2H2(g)+O2(g) △H=+484 kJ·mol-1
不同时段产生O2的量见下表:
|
时间/min |
20 |
40 |
60 |
80 |
|
n(O2)/mol |
0.0010 |
0.0016 |
0.0020 |
0.0020 |
则前20 min的反应速率 v(H2O)= ▲ ;
达平衡时,至少需要吸收的光能为 ▲ kJ。
 ③向某密闭容器中加入 0.3molA、0.1molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示。附图中乙图为t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件,所用条件均不同。已知,t3-t4阶段为使用催化剂[已知t0-t1阶段c(B)未画出]。请回答:
③向某密闭容器中加入 0.3molA、0.1molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示。附图中乙图为t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件,所用条件均不同。已知,t3-t4阶段为使用催化剂[已知t0-t1阶段c(B)未画出]。请回答:
I:t4-t5阶段改变的条件为 ▲ ,
II:B的起始物质的量为 ▲ 。
15.N2O5是一种新型硝化剂,在一定温度下可发生下列反应:
 2N2O5(g) 4NO2(g)+ O2(g) △H >0
2N2O5(g) 4NO2(g)+ O2(g) △H >0
T1温度下的部分实验数据为:
|
t/s |
0 |
500 |
1000 |
1500 |
|
c(N2O5)mol/L |
5.00 |
3.52 |
2.50 |
2.50 |
下列说法中,不正确的是
A.当反应体系内气体的平均相对分子质量不再发生变化时则该反应达到了平衡
B.T1温度下的平衡常数为K1 =125,1000s时转化率为50%
C.其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,则T1 >T2
D.T1温度下的平衡常数为K1 ,若维持T1温度不变,增加体系压强,达到新平衡时,平衡常数为K2,则K1> K2
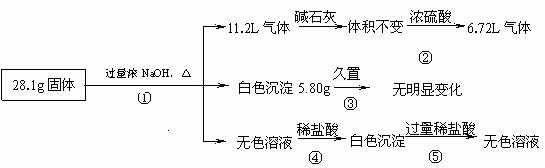 22.(8分)某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
22.(8分)某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):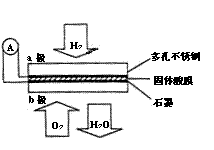 某固体酸性燃料电池以Ca(HSO4)2固体为电解质传递
某固体酸性燃料电池以Ca(HSO4)2固体为电解质传递