摘要:25℃时.有关弱酸的电离平衡常数如下: 弱酸化学式 CH3COOH HCN H2CO3 电离平衡常数 1.8×10-5 4.9×10-10 K1=4.3×10-7 K2=5.6×10-11 回答下列问题: (1)等物质的量浓度的CH3COONa.NaHCO3.NaCN溶液中CH3COO-.HCO3-.CN-的大小关系为: (2)a mol/L NaOH溶液与b mol/LHCN溶液等体积混合后.所得溶液中c(Na+)=c(CN-).则a b在冰醋酸中逐滴加水.则溶液的导电性将如何变化 醋酸的电离程度将如何变化 电离平衡常数将如何变化 (4)合成氨发生的反应为N2+3H2 2NH3.400"C时.该反应平衡常数K=0.5mol-2.·L2.已知该反应的平衡常数与温度的关系如图所示.500℃时.在 0.5L的定容容器中进行合成氨反应.一段时间后.测得N2.H2.NH3的物质的量分别是2mol.1mol.2mol.则此时反应 V(N2)正 v(N2)逆 (填>.<.=或不能确定).请书写判断理由 ww.k@s@5@ 高#考#资#源#网 10.高铁酸盐在能源.环保等方面有着广泛的用途.湿法.干法制备高铁酸盐的原理如下表所示. 湿法 强碱性介质中.Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 干法 Fe2O3.KNO3.KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 (1) 工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示: (2) ①反应I的化学方程式为 . ②反应II的离子方程式为 . ③加入饱和KOH溶液的目的是 . (2)高铁酸钾是一种理想的水处理剂.其处理水的原理为 . . (3)干法制备K2FeO4的反应中.氧化剂与还原剂的物质的量之比为 . (4)高铁电池是正在研制中的可充电干电池.右图为该电池和常用的高能碱性电池的放电曲线.由此可得出的高铁电池的优点有 . .
网址:http://m.1010jiajiao.com/timu3_id_432884[举报]
25℃时,有关弱酸的电离平衡常数如下:
回答下列问题:
(1)等物质的量浓度的CH3COONa、NaHCO3、NaCN溶液中CH3COO-、HCO3-、CN-的大小关系为:
(2)a mol/L NaOH溶液与b mol/LHCN溶液等体积混合后,所得溶液中c(Na+)=c(CN-),则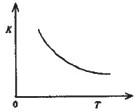 a
a
(3)在冰醋酸中逐滴加水,则溶液的导电性将如何变化
醋酸的电离程度将如何变化
电离平衡常数将如何变化
(4)合成氨发生的反应为N2+3H2 2NH3.400“C时,该反应平衡常数K=0.5mol-2.?L2.已知该反应的平衡常数与温度的关系如图所示.500℃时,在 0.5L的定容容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别是2mol、1mol,2mol,则此时反应 V(N2)正
查看习题详情和答案>>
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
(1)等物质的量浓度的CH3COONa、NaHCO3、NaCN溶液中CH3COO-、HCO3-、CN-的大小关系为:
c(CN-)<c(HCO3-)<c(CH3COO-)
c(CN-)<c(HCO3-)<c(CH3COO-)
(2)a mol/L NaOH溶液与b mol/LHCN溶液等体积混合后,所得溶液中c(Na+)=c(CN-),则
 a
a<
<
b(填>、<、=)(3)在冰醋酸中逐滴加水,则溶液的导电性将如何变化
先增大再减小
先增大再减小
醋酸的电离程度将如何变化
增大
增大
电离平衡常数将如何变化
不变
不变
(4)合成氨发生的反应为N2+3H2 2NH3.400“C时,该反应平衡常数K=0.5mol-2.?L2.已知该反应的平衡常数与温度的关系如图所示.500℃时,在 0.5L的定容容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别是2mol、1mol,2mol,则此时反应 V(N2)正
<
<
v(N2)逆(填>、<、=或不能确定).请书写判断理由Q=0.5,而500℃时K<o.5,Q<K,平衡往逆方向移动
Q=0.5,而500℃时K<o.5,Q<K,平衡往逆方向移动
.25℃时,有关弱酸的电离平衡常数如下,则下列有关说法正确的是( )
|
查看习题详情和答案>>
(2010?漳州二模)25℃时,有关弱酸的电离平衡常数如下:下列有关说法正确的是( )
|
查看习题详情和答案>>
已知25℃时,有关弱酸的电离平衡常数:
|
查看习题详情和答案>>