20.(8分)10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
|
温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
|
pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度
(填“大于”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则 (填
“甲”或“乙”)判断正确。试剂X是 。
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH (填“高于”、“低于”
或“等于”)8.3,则 (填“甲”或“乙”)判断正确。
(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言 (填“甲”或“乙”)判断是错误的,理由是 。
18.
已知:CO(g)+H2O(g)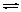 H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数K |
9.94 |
9 |
1 |
(1)上述正向反应是: 反应(填“放热”或“吸热”)
(2)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有 (选填A、B、C、D、E)。
|
|
n(CO) |
n(H2O) |
n(H2) |
n(CO2) |
|
A |
1 |
5 |
2 |
3 |
|
B |
2 |
2 |
1 |
1 |
|
C |
3 |
3 |
0 |
0 |
|
D |
0.5 |
2 |
1 |
1 |
|
E |
3 |
1 |
2 |
1 |
试回答下列问题
(3)已知在一定温度下,C(s)+CO2(g)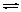 2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s)+H2O(g)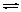 CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;
CO(g)+H2O(g)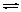 H2(g)+CO2(g)平衡常数K2
H2(g)+CO2(g)平衡常数K2
则K、K1、K2之间的关系是: 。
(4)若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为: 。
(5)若反应在800℃进行,设起始时CO和H2O(g)共为5mol,水蒸气的体积分数为x;平衡时CO转化率为y,则y随x变化的函数关系式为:y= 。
(6)在VL密闭容器中通入10 molCO和10 mol水蒸气,在T℃达到平衡,然后急速通过碱石灰,将所得混合气体燃烧,测得放出的热量为2842kJ(已知CO燃烧为283 kJ/mol,H2燃烧热为286/kJmol),则T℃平衡常数K= 。
13.下列解释实验事实的方程式不正确的是
A.0.1 /L
/L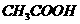 溶液的PH>1:
溶液的PH>1: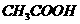
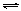 CH3COO-+H+
CH3COO-+H+
B.向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO32-+H2O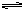 HCO-3+OH-
HCO-3+OH-
C.氯化铵溶液与金属镁发生反应,并产生氢气 NH4++H2O
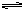 NH3·H2O+H+
NH3·H2O+H+
|
 Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
 水的电离平衡如图所示:
水的电离平衡如图所示: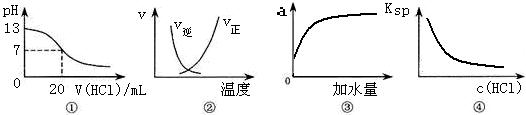
 2NO(g) ΔH >0正、逆反应速率随温度的变化
2NO(g) ΔH >0正、逆反应速率随温度的变化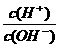 电解质溶液的酸度(用AG表示)定义为 C(H+)与C(OH-)比值的对数,即AG=lg 。常温下,下列各组离子在AG=12的无色溶液中能大量共存的是( )
电解质溶液的酸度(用AG表示)定义为 C(H+)与C(OH-)比值的对数,即AG=lg 。常温下,下列各组离子在AG=12的无色溶液中能大量共存的是( )