33.(16分)
(1)工业上以粗铜为原料采取如图17所示流程制备硝酸铜晶体:


①在步骤a中,还需要通入氧气和水,其目的是 。
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在 范围。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ Cu2+ |
1.9 4.7 |
3.2 6.7 |
不用加水的方法调节溶液pH的原因是 。
 ③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明)
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明)
。
(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是 。
(3)图18是某小组同学查阅资料所绘出的硝酸铜晶体[ Cu(NO3)2·nH2O ]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是 (填字母)。
a. A点时的溶液为不饱和溶液
b. B点时两种晶体可以共存
c. 按上述流程最终得到的晶体是Cu(NO3)2·3H2O
d.若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2·6H2O晶体
32、(16分)草酸(H2C2O4)是一种有机二元弱酸,水溶液中草酸的存在形态有三种,各形态的浓度分数α(H2C2O4-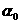 ,HC2O4--
,HC2O4--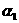 ,C2O42--
,C2O42--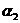 )随溶液pH变化的关系如图所示:
)随溶液pH变化的关系如图所示:
 (1)草酸钠溶液中,
(1)草酸钠溶液中, 2(填“>” “==” 或“<”);往该溶液中滴入氯化钙溶液后,
2(填“>” “==” 或“<”);往该溶液中滴入氯化钙溶液后,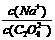 增加,可能的原因是 。
增加,可能的原因是 。
(2)往草酸钠溶液中滴稀盐酸,pH=5时溶液中存在的阴离子有 ,pH=3时,以上两种物质发生的主要反应的离子方程式为 。
(3)菠菜富含草酸,菠菜不能与牛奶、豆腐一起食用的原因是 。
(4)将适量草酸亚铁(FeC2O4·H2O)粉末加入试管中,在酒精灯上边加热边摇动,发生剧烈反应,产生的气体可使燃着木条熄灭,同时生成黑色粉末。反应即将结束时,将所得的黑色粉末撒在石棉网上,便会立即自燃起来。
草酸亚铁粉末受热分解的化学方程式为 ,自燃的原因是 。
(5)下表为几种酸对铁锈及锅炉水垢的溶解性比较:
|
酸 |
铁锈[Fe(OH)3]溶解量/g |
水垢(CaCO3)溶解量/g |
|
盐酸 |
0.7911 |
全溶 |
|
磷酸 |
0.1586 |
微溶 |
|
草酸 |
0.7399 |
0.0036 |
|
醋酸 |
0.1788 |
0.1655 |
下列说法正确的有 (选填字母)。
A.同物质的量浓度时,酸性越强的酸除铁锈效果越好
B.草酸除水垢效果差的原因是因为草酸酸性太弱
C.铁锈或水垢在酸中的溶解性与酸根离子的性质可能有关
D.硫酸除铁锈和水垢的效果都好
30、(16分)铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。实验室现有下列试剂: 0.01 mol/L 酸性KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
[提出猜想]
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有 中的一种或两种。
[实验探究]
|
|
实验操作 |
预期现象 |
结
论 |
|
验证猜想Ⅰ |
步骤①:取少量0.01 mol/L
酸性KMnO4溶液,滴入所得溶液 |
|
|
|
步骤②: |
|
含有Fe3+ |
|
|
验证猜想Ⅱ |
将所得气体通入如下装置 |
|
含有两种气体 |


[问题讨论]有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,判断该方法是否正确并进行评价:
。

 A.该反应的热化学方程式为:
A.该反应的热化学方程式为: 2NH3,△H=-92kJ·mol-1
2NH3,△H=-92kJ·mol-1 LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为: FePO4+Li LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨和锂,含Li+ 导
LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为: FePO4+Li LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨和锂,含Li+ 导
 测定生成气体的体积
测定生成气体的体积
 测定剩余固体的质量
测定剩余固体的质量  D.用新制的Cu(OH)2可检验尿液中的葡萄糖
D.用新制的Cu(OH)2可检验尿液中的葡萄糖