网址:http://m.1010jiajiao.com/timu3_id_84855[举报]
_________。
a.加热
b.检查装置的气密性
c.向A中缓缓鼓入干燥的空气
d.取下D装置
(2)甲、乙两组实验中,给定的A、B、E、H中需要加热的是(填写编号)__________。
(3)反应开始后,C中观察到的现象是________________。

图1
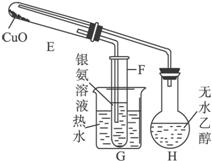
图2
(4)写出E中发生反应的化学方程式__________________。
查看习题详情和答案>>

图(1) 图(2)
(1)甲组要完成全部实验内容,有如下步骤,正确的顺序是___________。(填写序号,步骤可重复)
a.加热 b.检查装置的气密性
c.向A中缓缓鼓入干燥的空气 d.取下D装置
(2)甲、乙两组实验中,给定的A、B、E、H中需要加热的是___________。(填写编号)
(3)反应开始后,C中观察到的现象是_____________________。
(4)写出E中发生反应的化学方程式____________________________________________。
查看习题详情和答案>>选择性催化还原(SCR)是在有催化剂的条件下将NOx 转变为N2和H2O,这是目前国外硝酸厂进行尾气治理所普遍采用的一种方法。
某校甲、乙两个化学兴趣小组拟验证NO能被氨气还原并测算其转化率。
(一)甲组拟制取活性亚铬酸铜催化剂
亚铬酸铜(Adkin催化剂)是极好的NO催化还原的催化剂,是铜和铬的复合氧化物,成分不固定,如:CuO·Cr2O3等,统称为亚铬酸铜。该组同学取一定量硝酸铜溶液(并加少量硝酸钡作稳定剂)、 重铬酸铵溶液与氨水作用得土黄色沉淀, 将沉淀物[经测定为:碱式铬酸铜铵(CuNH4(OH)CrO4 )]过滤、洗涤,80℃烘干12h, 最后焙烧。
(1)过滤用到的玻璃仪器有: ▲ (选填序号,下同);焙烧用到的仪器有: ▲ 。
A.蒸发皿 B.石棉网 C.泥三角 D.烧杯 E.坩埚钳 F.酒精灯
G.玻璃棒 H.漏斗 I.坩埚(部分仪器已略去)
(2)CuNH4(OH)CrO4在295℃分解生成复合的氧化物(催化剂)、氮气及水,该反应的化学方程式: ▲ 。
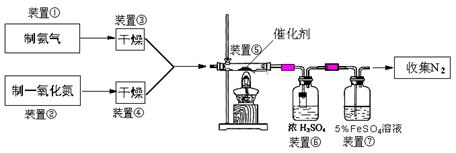
(二)乙组拟用甲组制得催化剂按下列流程进行实验。
试回答下列问题:
(3)若制取氨气在A装置,则发生反应的化学方程式为: ▲ ;
若用B装置制取氨气,则分液漏斗和锥形瓶中盛放的药品分别是: ▲ 。
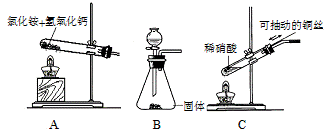
(4)用图C装置制取NO时,用可抽动的铜丝其优点是: ▲ ;
(5)装置⑦的作用可能是: ▲ 。
(6)若进入装置⑤的NO共2688mL(已折算为标准状况,下同),氨气过量,最后收集到标准状况下2016mLN2,则NO的转化率为: ▲ 。
查看习题详情和答案>>
(1)甲、乙两组实验中,下列给定的A、B、E和H装置中需要加热的是(填写装置编号)_________。
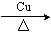
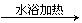
(2)甲组实验开始后,C中观察到的现象是___________,其作用是_________________。
(3)甲组实验进行一段时间后,为验证乙醇的氧化产物,应怎样进行实验操作?(指明操作、实验现象和结论)
(4)从验证产物的功能上分析______组的实验设计更佳。理由是:__________________。
(5)写出B、F中发生反应的化学方程式。
B:________________。
F:________________。
查看习题详情和答案>>(12分)选择性催化还原(SCR)是在有催化剂的条件下将NOx 转变为N2和H2O,这是目前国外硝酸厂进行尾气治理所普遍采用的一种方法。
.某校甲、乙两个化学兴趣小组拟验证NO能被氨气还原并测算其转化率。
(一)甲组拟制取活性亚铬酸铜催化剂
亚铬酸铜(Adkin催化剂)是极好的NO催化还原的催化剂,是铜和铬的复合氧化物,成分不固定,如:CuO?Cr2O3等,统称为亚铬酸铜。该组同学取一定量硝酸铜溶液(并加少量硝酸钡作稳定剂)、重铬酸铵溶液与氨水作用得土黄色沉淀, 将沉淀物[经测定为:碱式铬酸铜铵(CuNH4(OH)CrO4 )]过滤、洗涤,80℃烘干12h, 最后焙烧。
(1)过滤用到的玻璃仪器有: (选填序号,下同);焙烧用到的仪器有: 。
A.蒸发皿 B.石棉网 C.泥三角 D.烧杯 E.坩埚钳 F.酒精灯
G.玻璃棒 H.漏斗 I.坩埚(部分仪器已略去)
(2)CuNH4(OH)CrO4在295℃分解生成复合的氧化物(催化剂)、氮气及水,该反应的化学方程式: 。
(二)乙组拟用甲组制得催化剂按下列流程进行实验。
![]()

试回答下列问题:
(3)若制取氨气在A装置,则发生反应的化学方程式为: ;若用B装置制取氨气,则分液漏斗和锥形瓶中盛放的药品分别是: 。
![]()

(4)用图C装置制取NO时,用可抽动的铜丝其优点是: ;
(5)装置⑦的作用可能是: 。
(6)若进入装置⑤的NO共2688 mL(已折算为标准状况,下同),氨气过量,最后收集到标准状况下2016 mL N2,则NO的转化率为: 。
查看习题详情和答案>>