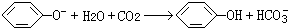摘要:18.(2010·北京市东城区检测)某同学设计了如图所示装置进行系列实验.实验时将药品A逐滴加入到固体B中.请回答下列问题: (1)若A为浓氨水.B为烧碱.C为AlCl3溶液.打开分液漏斗旋塞.烧瓶中即有氨气生成.原因是 .一段时间后.观察到试管中的现象是 .发生反应的离子方程式是 . (2)利用该装置设计实验证明醋酸.碳酸.苯酚的酸性强弱.若B为碳酸钠.C为苯酚钠溶液.A与B发生反应的离子方程式是 .得到的相应结论是 ,试管中出现浑浊.依据此现象能否得出相应的结论.并简述理由: . 答案:(1)在氨水中存在下列平衡:NH3+H2OƒNH3·H2OƒNH+OH-.NaOH固体溶于水放热.使得氨气的溶解度减小.同时增大了溶液中的c(OH-).促使化学平衡逆向移动 有白色沉淀产生 Al3++3NH3·H2O===Al(OH)3↓+3NH (2)CO+2CH3COOH===2CH3COO-+H2O+CO2↑ 醋酸的酸性强于碳酸 不能.因为醋酸具有挥发性.挥发出的醋酸可以和苯酚钠溶液发生反应.生成苯酚
网址:http://m.1010jiajiao.com/timu3_id_84856[举报]
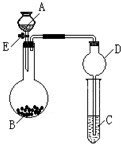 某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:(1)若A为水,B为过氧化钠,C中盛有酸化过的FeCl2溶液,旋开活塞E后,C中的现象为
溶液由浅绿色逐渐变为(棕)黄色
溶液由浅绿色逐渐变为(棕)黄色
,C中发生反应的离子方程式为
4Fe2++O2+4H+=4Fe3++2H2O
4Fe2++O2+4H+=4Fe3++2H2O
;(2)利用上述装置还可以验证物质的性质,如设计证明氧化性:KMnO4>Cl2,并制取漂白液,则A中加浓盐酸,B中加
高锰酸钾(酸性高锰酸钾)
高锰酸钾(酸性高锰酸钾)
溶液,C中发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.(3)利用上述装置还可以验证SO2的化学性质,A为硫酸,B为亚硫酸钠固体,那么C中盛有
氯水(或溴水或酸性高锰酸钾溶液)
氯水(或溴水或酸性高锰酸钾溶液)
溶液时可验证其还原性; 而C中盛有品红
品红
溶液时可验证其漂白性. 某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:(1)若A为水,B为过氧化钠,C中盛有盐酸酸化过的FeCl2溶液,旋开活塞E后,B中发生反应的化学方程式为
2Na2O2+2H2O=4NaOH+O2
2Na2O2+2H2O=4NaOH+O2
;C中现象为变黄或加深
变黄或加深
.(2)若A为硫酸,B为亚硫酸钠固体,C中盛有氢硫酸溶液,旋开活塞E后,B中发生反应的化学方程式的为
H2SO4+Na2SO3=Na2SO4+H2O+SO2
H2SO4+Na2SO3=Na2SO4+H2O+SO2
,C中发生反应的化学方程式的为2H2S+SO2=3S+2H2O
2H2S+SO2=3S+2H2O
.(3)利用上述装置还可以验证物质的性质,如设计证明氧化性:KClO3>Cl2>Br2,则A中加浓盐酸,B中加
KClO3
KClO3
,C中发生反应的离子方程式为2Br-+Cl2=2Cl-+Br2
2Br-+Cl2=2Cl-+Br2
. 某同学设计了如图所示装置(部分夹持装置已略去)进行实验研究.请回答:
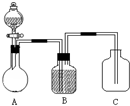
某同学设计了如图所示装置(部分夹持装置已略去)进行实验研究.请回答:(1)用上述装置探究影响化学反应速率的因素.
①圆底烧瓶中发生反应的离子方程式是
Zn+2H+=Zn2++H2↑
Zn+2H+=Zn2++H2↑
.②用上述装置进行实验,以生成9.0mL气体为计时终点,结果为t1>t2.
| 序号 | V(H2SO4)/mL | C(H2SO4)/mol?L-1 | t/s |
| I | 40 | 1 | t1 |
| II | 40 | 4 | t2 |
在其它条件一定时,化学反应速率随反应物浓度的增大而增大
在其它条件一定时,化学反应速率随反应物浓度的增大而增大
.实验过程中,对量气管的操作是
调整量气管,使其左右管中水面始终持平
调整量气管,使其左右管中水面始终持平
.③若将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据.粗锌片中所含杂质可能是(填序号)
abc
abc
.A.石墨 b.银 c.铜d.沙粒(二氧化硅)
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀.
①圆底烧瓶中的试剂可选用(填序号)
ac
ac
.a.NaOH溶液 b.C2H5OH c.NaCl溶液 d.稀硫酸
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是
量气管右端液面下降,左端液面上升
量气管右端液面下降,左端液面上升
. 某同学设计了如图所示装置(部分夹持装置已略去)进行实验研究.
某同学设计了如图所示装置(部分夹持装置已略去)进行实验研究.请回答:
(1)用上述装置探究影响化学反应速率的因素.
①圆底烧瓶中发生反应的离子方程式是
Zn+2H+=Zn2++H2↑
Zn+2H+=Zn2++H2↑
.②用如图所示装置进行实验,以生成9.0mL气体为计时终点,结果为t1>t2.
| 序号 | V(H2SO4)/mL | c(H2SO4)/mol?L-1 | t/s | Ⅰ | 40 | 1 | t1 | Ⅱ | 40 | 4 | t2 |
在其它条件一定时,化学反应速率随反应物浓度的增大而增大
在其它条件一定时,化学反应速率随反应物浓度的增大而增大
.③若将锌片换成含粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验的数据.粗锌片中所含杂质可能是(填序号)
abc
abc
. a.石墨 b.银 c.铜 d.沙粒(二氧化硅)
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀.生铁放在烧瓶中,则
①圆底烧瓶中的试剂可选用(填序号)
ac
ac
.a.NaOH溶液 b.C2H5OH c.NaCl溶液 d.稀硫酸
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是
量气管右端液面下降,左端液面上升
量气管右端液面下降,左端液面上升
. 为确认C6H5OH、H2CO3、CH3COOH的酸性强弱,某同学设计了如图所示装置,一次实验即可达到目的(不必选用其他酸性物质).
为确认C6H5OH、H2CO3、CH3COOH的酸性强弱,某同学设计了如图所示装置,一次实验即可达到目的(不必选用其他酸性物质).