摘要:[基础等级评价]1.利用电解法可将含有Fe.Zn.Ag.Pt等杂质的粗铜提纯.下列叙述正确的是( ) A.电解时以精铜作阳极 B.电解时阴极发生氧化反应 C.粗铜连接电源负极.其电极反应是Cu===Cu2++2e- D.电解后.电解槽底部会形成含少量Ag.Pt等金属的阳极泥 解析:电解精炼铜时.粗铜作阳极.精铜作阴极.活泼性比铜弱的金属沉积在电解糟底部形成阳极泥. 答案:D
网址:http://m.1010jiajiao.com/timu3_id_84764[举报]
某化学兴趣小组的同学利用如图所示的实验装置进行实验(图中a、b、c表示止水夹).

请按要求填空:
(1)利用B装置可制取的气体有
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.若在丙中加入适量水,即可制得氯水.将所得的氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象及结论如表所示:
请你评价实验Ⅰ、Ⅱ的结论是否合理?请说明理由:
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验.
①B中发生反应的化学方程式为
②欲用D装置验证NO2与水的反应,其操作步骤为先关闭止水夹
查看习题详情和答案>>

请按要求填空:
(1)利用B装置可制取的气体有
H2、NO
H2、NO
(任写两种即可).(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.若在丙中加入适量水,即可制得氯水.将所得的氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象及结论如表所示:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯气滴入品红溶液中 | 溶液褪色 | 氯气与水反应的产物有漂白粉 |
| Ⅱ | 向氯气中加入碳酸氢钠粉末 | 产生气泡 | 氯气与水反应的产物具有酸性 |
实验Ⅰ结论合理,实验Ⅱ结论不合理,因为制取的氯气中含有氯化氢气体,氯化氢溶于水后能与碳酸氢钠粉末反应产生气泡,不能说明酸性是氯气和水反应生成的产物造成的.
实验Ⅰ结论合理,实验Ⅱ结论不合理,因为制取的氯气中含有氯化氢气体,氯化氢溶于水后能与碳酸氢钠粉末反应产生气泡,不能说明酸性是氯气和水反应生成的产物造成的.
.(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验.
①B中发生反应的化学方程式为
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
.②欲用D装置验证NO2与水的反应,其操作步骤为先关闭止水夹
ab
ab
,再打开止水夹C
C
,使烧杯中的水进入试管丁的操作是双手紧握(或微热)试管丁使试管中气体逸出,二氧化氮与水接触后即可引发烧杯中的水倒流到试管丁中
双手紧握(或微热)试管丁使试管中气体逸出,二氧化氮与水接触后即可引发烧杯中的水倒流到试管丁中
.Ⅰ.一氧化碳是一种用途相当广泛的化工基础原料.
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍.
Ni(s)+4CO(g) Ni(CO)4(g) 该反应的△H
Ni(CO)4(g) 该反应的△H
(2)在高温下一氧化碳可将二氧化硫还原为单质硫.已知:
C(s)+O2(g)=CO2(g)△H1=-393.5kJ?mol-1
CO2(g)+C(s)=2CO(g)△H2=+172.5kJ?mol-1
S(s)+O2(g)=SO2(g)△H3=-296.0kJ?mol-1
请写出CO除SO2的热化学方程式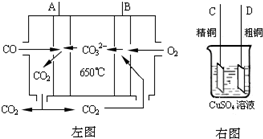
(3)如图中左图是一碳酸盐燃料电池,它以CO为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质,右图是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验.回答下列问题:
①写出A极发生的电极反应式
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与
③当消耗2.24L(标况下)CO时,粗铜电极理论上减少铜的质量
Ⅱ.(1)已知Na2CrO4溶液酸化时发生的反应为:2CrO42-+2H+?Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总物质的量为0.55mol,CrO42-有
转化为Cr2O72-.又知:常温时该反应的平衡常数K=1014.上述酸化后所得溶液的pH=
(2)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol?L-1以下才能排放.含CrO42-的废水处理通常有以下两种方法.
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+.加入可溶性钡盐后的废水中Ba2+的浓度应不小于
②还原法:CrO42-
Cr3+
Cr(OH)3.用该方法处理10m3 CrO42-的物质的量浓度为1.0×10-3 mol?L-1的废水,至少需要绿矾(FeSO4?7H2O,相对分子质量为278)
查看习题详情和答案>>
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍.
Ni(s)+4CO(g)
 Ni(CO)4(g) 该反应的△H
Ni(CO)4(g) 该反应的△H<
<
0 (选填“>”或“=”或“<”).(2)在高温下一氧化碳可将二氧化硫还原为单质硫.已知:
C(s)+O2(g)=CO2(g)△H1=-393.5kJ?mol-1
CO2(g)+C(s)=2CO(g)△H2=+172.5kJ?mol-1
S(s)+O2(g)=SO2(g)△H3=-296.0kJ?mol-1
请写出CO除SO2的热化学方程式
2CO(g)+SO2(g)=S(s)+2CO2(g)△H3=-270kJ?mol-1
2CO(g)+SO2(g)=S(s)+2CO2(g)△H3=-270kJ?mol-1
.
(3)如图中左图是一碳酸盐燃料电池,它以CO为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质,右图是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验.回答下列问题:
①写出A极发生的电极反应式
CO-2e-+CO32-=2CO2
CO-2e-+CO32-=2CO2
.②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与
D
D
极 (填:“C”或“D”)相连.③当消耗2.24L(标况下)CO时,粗铜电极理论上减少铜的质量
小于
小于
(填:“大于”、“等于”或“小于”)6.4克.Ⅱ.(1)已知Na2CrO4溶液酸化时发生的反应为:2CrO42-+2H+?Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总物质的量为0.55mol,CrO42-有
| 10 |
| 11 |
6
6
.(2)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol?L-1以下才能排放.含CrO42-的废水处理通常有以下两种方法.
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+.加入可溶性钡盐后的废水中Ba2+的浓度应不小于
2.4×10-4
2.4×10-4
mol?L-1,然后再进行后续处理方能达到国家排放标准.②还原法:CrO42-
| ||
| 氢离子 |
| 石灰水 |
8.34
8.34
Kg(保留两位小数).
材料是人类赖以生存和发展的重要物质基础.
(1)制造普通玻璃的主要原料是纯碱(Na2CO3)、石灰石(CaCO3)和 ;通常所说的三大合成材料是指塑料、 和合成橡胶.
(2)右图是钢铁在酸性环境中的电化学腐蚀示意图.其主要反应原理是:钢铁里的铁和少量的碳以及钢铁 表面的水膜构成了原电池,使铁不断被氧化而腐蚀.该原电池的正极为 (填“铁”或“碳”),负极的电极反应式为 .
表面的水膜构成了原电池,使铁不断被氧化而腐蚀.该原电池的正极为 (填“铁”或“碳”),负极的电极反应式为 .
(3)右图表示了铁、铝、铜被开发利用的大致年限,由图中数据和所学知识分析,与金属大规模开发利用先后顺序有关的是 (填“金属的活动性”或“地壳中金属的含量”);铝的活动性比铁强,但铝在空气中却表现出良好的抗腐蚀性,其原因是 . 查看习题详情和答案>>
查看习题详情和答案>>
(1)制造普通玻璃的主要原料是纯碱(Na2CO3)、石灰石(CaCO3)和
(2)右图是钢铁在酸性环境中的电化学腐蚀示意图.其主要反应原理是:钢铁里的铁和少量的碳以及钢铁
 表面的水膜构成了原电池,使铁不断被氧化而腐蚀.该原电池的正极为
表面的水膜构成了原电池,使铁不断被氧化而腐蚀.该原电池的正极为(3)右图表示了铁、铝、铜被开发利用的大致年限,由图中数据和所学知识分析,与金属大规模开发利用先后顺序有关的是
 查看习题详情和答案>>
查看习题详情和答案>>
一氧化碳是一种用途相当广泛的化工基础原料.
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍.Ni(s)+4CO(g)
Ni(CO)4(g),该反应的△H 0(选填“>”或“=”或“<”)
(2)金属氧化物被一氧化碳还原生成金属单质和二氧化碳.如图1是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时lg
与温度(t)的关系曲线图.则一氧化碳还原三氧化铬反应的化学平衡常数表达式可表示为:K= .800℃时,其中最易被还原的金属氧化物是 ,该反应的平衡常数数值(K)等于 .
(3)如图2是一碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质.写出B极发生的电极反应式 .

查看习题详情和答案>>
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍.Ni(s)+4CO(g)
| ||
| 180-200℃ |
(2)金属氧化物被一氧化碳还原生成金属单质和二氧化碳.如图1是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时lg
| c(CO) |
| c(CO2) |
(3)如图2是一碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质.写出B极发生的电极反应式
