|
分 散 系 |
溶 液 |
胶 体 |
浊 液 |
|
分散质粒子大小 |
<1 nm |
1 nm-100 nm |
>100 nm |
|
外 观 |
均一透明 |
多数均一透明 |
不均一、不透明 |
|
分散质粒子 |
单个分子或离子 |
分子集合体或大分子 |
许多分子集合体 |
|
能否透过滤纸 |
能 |
能 |
不能 |
|
能否透过半透膜 |
能 |
不能 |
不能 |
|
稳定性 |
稳定 |
较稳定 |
不稳定 |
|
实 例 |
盐酸、食盐水 |
鸡蛋的溶液等 |
泥水、牛奶 |
3.美国科学家鲍林在研究含氧酸的强弱时,提出了一个定性判断的经验规律,即含氧酸分子中的非羟基氧原子数与酸的强弱成相关性。设含氧酸化学式为HnROm,则非羟基氧原子数为(m-n),其数值越大,该含氧酸越强。
|
m-n |
0 |
1 |
2 |
3 |
|
含氧酸强度 |
弱酸 |
中强酸 |
强酸 |
最强酸 |
|
实例 |
HClO |
H3PO3 |
HNO3 |
HClO4 |
已知亚磷酸(H3PO3)是中强酸,H3AsO3(亚砷酸)既有弱酸性又有弱碱性。
(1)写出在亚磷酸溶液中加入过量氢氧化溶液反应的离子方程式: ;
(2)写出在H3PO3和H3AsO3中分别加入盐酸,能反应的写出化学程式: ;
(3)在亚磷酸溶液中滴加硝酸银溶液,有黑色沉淀银生成及无色气体放出,写出此反应的化学方程式: ;
(4)该鲍林规则只是经验性的,有些例外,举一例: 。
[答案](1)H3PO3+2OH-=HPO32-+2H2O;
(2)H3AsO3+3HCl=AsCl3+3H2O
(3)2H3PO3+AgNO3=2H3PO4+Ag↓+NO↑
(4)H2CO3,m-n=1,但碳酸是弱酸,还有HCOOH、CH3COOH等。
 漂白草帽生成物不稳定,时间一长会分解,又变为黄色,因此都是化学变化,而D中Fe(OH)3胶体中加入电解质MgSO4,使胶体聚沉而产生Fe(OH)3沉淀,没有新物质生成,只有物理变化。
漂白草帽生成物不稳定,时间一长会分解,又变为黄色,因此都是化学变化,而D中Fe(OH)3胶体中加入电解质MgSO4,使胶体聚沉而产生Fe(OH)3沉淀,没有新物质生成,只有物理变化。 思路分析
思路分析 ,氧化物A是SiO2,它除了跟氢氟酸反应外不与任何酸反应,可知I为HF,由反应④可得HF和单质可知该反应为
,氧化物A是SiO2,它除了跟氢氟酸反应外不与任何酸反应,可知I为HF,由反应④可得HF和单质可知该反应为 。
。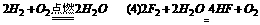
 (2)中和反应都是放热反应,测定“0.50mol/L50mL盐酸和0.55mol/L50mL氢氧化钠溶液反应放出的热量”,将两溶液混合时应将两溶液一次性全部混合,不能逐滴加入,这样操作的目的是
;
(2)中和反应都是放热反应,测定“0.50mol/L50mL盐酸和0.55mol/L50mL氢氧化钠溶液反应放出的热量”,将两溶液混合时应将两溶液一次性全部混合,不能逐滴加入,这样操作的目的是
; H++CN-(2分);> (1分);
H++CN-(2分);> (1分);
 (3分)
(3分)
 等(3分)
等(3分)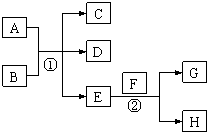
 CaCl2 +2H2O+2NH3↑
(3分)
CaCl2 +2H2O+2NH3↑
(3分)