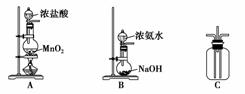
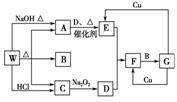
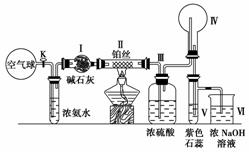
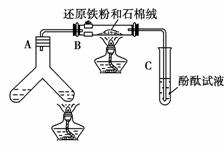
FeCl3与KSCN溶液反应
|
编号 |
混合溶液颜色 |
滴加的溶液 |
溶液颜色的变化 |
平衡移动的方向 |
|
1 |
橙红色 |
FeCl3 |
①颜色____了,由橙红色变成了____色 |
③向____移动 |
|
2 |
橙红色 |
KSCN |
②颜色____了,由橙红色变成了____色 |
④向____移动 |
|
3 |
橙红色 |
KCl |
颜色变浅了,由橙红色变成了黄色 |
⑤向____移动 |
|
4 |
橙红色 |
NaF |
颜色变浅了,由橙红色变成了无色 |
⑥向____移动 |
|
5 |
橙红色 |
- |
橙红色 |
不移动 |
(1)由①②现象说明假设________成立,假设________不成立。
(2)根据Fe3++SCN- Fe(SCN)3,加入KCl固体,颜色不应该有变化,但现象却是变浅了,请你分析变浅的可能原因是
。
Fe(SCN)3,加入KCl固体,颜色不应该有变化,但现象却是变浅了,请你分析变浅的可能原因是
。
(3)根据“4”号试管中的现象,分析在4号试管中发生的变化是________________________________________________________________________,
说明了 。
(从改变浓度影响平衡移动角度回答)
解析:FeCl3与KSCN发生的化学反应为:
FeCl3+3KSCN Fe(SCN)3+3KCl,Fe3++3SCN-
Fe(SCN)3+3KCl,Fe3++3SCN- Fe(SCN)3。加入FeCl3或KSCN(增大反应物浓度)会使平衡向右移动,颜色加深,加入KCl固体,颜色变浅,说明平衡向左移动,可能是加入的Cl-与Fe3+形成配离子,减小了Fe3+的浓度。加入NaF溶液变为无色,说明F-与Fe3+形成了比Fe(SCN)3更稳定的配位化合物,使平衡向左移动。
Fe(SCN)3。加入FeCl3或KSCN(增大反应物浓度)会使平衡向右移动,颜色加深,加入KCl固体,颜色变浅,说明平衡向左移动,可能是加入的Cl-与Fe3+形成配离子,减小了Fe3+的浓度。加入NaF溶液变为无色,说明F-与Fe3+形成了比Fe(SCN)3更稳定的配位化合物,使平衡向左移动。
答案:①加深 红 ②加深 红 ③右 ④右 ⑤左 ⑥左 (1)1 2 (2)Fe3+与Cl-形成络离子,使Fe3+浓度减小,平衡向左移动 (3)F-与Fe3+形成了无色的且比Fe(SCN)3更稳定的化合物(络合物) 减小反应物的浓度会使平衡向逆反应方向移动。

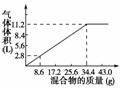
 N2O4,二氧化氮与四氧化二氮之间存在化学平衡,二氧化氮和四氧化二氮共存
N2O4,二氧化氮与四氧化二氮之间存在化学平衡,二氧化氮和四氧化二氮共存