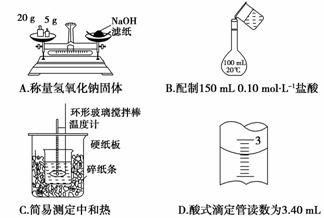
2.(2010·湖北众望高中月考)下列关于热化学反应的描述中正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
|

 C.N2(g)+3H2(g)
2NH3(g);ΔH<0,说明N-H键能总和小于N≡N与H-H键能总和
C.N2(g)+3H2(g)
2NH3(g);ΔH<0,说明N-H键能总和小于N≡N与H-H键能总和
D.稀溶液中:H+(aq)+OH-(aq)===H2O(l);ΔH=-57.3 kJ/mol,若将含0.5 mol H2SO4的稀硫酸与含0.5 mol Ba(OH)2的稀溶液混合,放出的热量等于57.3 kJ
解析:硫由气态变为固态会放出热量,因此等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多;N2(g)+3H2(g)催化剂高温、高压2NH3(g);ΔH<0,说明反应放热,6 mol N-H键能总和大于1 mol N≡N与3 mol H-H键能总和;稀硫酸与Ba(OH)2的稀溶液反应的离子方程式为:Ba2++2OH-+2H++SO42-===BaSO4↓+2H2O,虽然生成1 mol H1O(l),但反应的热效应与沉淀有关,故其放出的热量不等于57.3 kJ。
答案:B
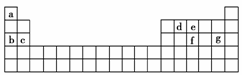
15.(2010×天津八校期中联考题)已知元素的电负性和原子半径一样,也是元素的一种基本性
质。短周期元素的电负性数值表。
|
元素 |
H |
Li |
Be |
B |
C |
N |
O |
F |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
|
电负性 |
2.1 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
0.9 |
1.2 |
1.5 |
1.8 |
2.1 |
2.5 |
3.0 |
0.8 |
请仔细观察表格中的数据,回答下列有关问题:
(1)根据表中的数据,可推测元素的电负性具有的变化规律是
________________________________________________________________________。
(2)由表中数据可得出同主族元素的电负性变化规律是
________________________________________________________________________。
(3)由表中数据预测电负性最大的元素为________;电负性较大与电负性较小的两元素之间
易形成的化学键类型是________。
解析:(1)根据所提供的主族元素的电负性数据及“元素的电负性和原子半径一样”可推出
元素的电负性随着原子序数的递增呈现周期性变化;(2)同主族元素的电负性随着原子序数
的增加而减小;(3)电负性越大的元素的非金属性越强,电负性越小的元素的金属性越强,
则两者易通过离子键形成离子化合物。
答案:(1)随着原子序数递增呈周期性变化 (2)从上到下逐渐减小 (3)F 离子键
12.(2010×改编题)下表是Na、Mg、Si、S、Br五种元素的单质的沸点,其中b、e均是热和电
的良导体。
|
单质 |
a |
b |
c |
d |
e |
|
沸点(℃) |
58.8 |
882.9 |
444.7 |
2
355 |
1
107 |
(1)a呈________色,a的元素在元素周期表中的位置为________。
(2)写出d的元素原子的电子式________;其最高价氧化物形成的晶体为________晶体(填类
型),溶于强碱的离子方程式为
________________________________________________________________________。
(3)c与氢形成的分子X的空间构型为________;写出X的水溶液与b的元素的最高价氧化
物对应水化物反应的离子方程式
________________________________________________________________________。
(4)上述元素所能形成的简单离子中半径最小的是________(填离子符号),最高价氧化物对
应水化物酸性最强的是________(填分子式),e元素与N元素形成化合物的电子式为
________。
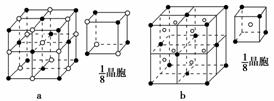
(5)写出b元素与氯元素形成的化合物Y的电子式________,Y晶体中,1个晶胞内含有的
基本微粒及个数是________。
解析:首先确定最高沸点对应的物质d是Si,最低的a为Br2;由b和e是热和电的良导体
,那么b为Na、e为Mg、c为S。其次代入(1)-(6)问题逐一分析(1)Br2是深棕红色液体;(2)SiO2
为原子晶体,可与强碱反应;(3)H2S为V型分子;(4)Mg2+半径最小,Mg3N2是离子化合物;
(5)NaCl晶胞中含有4个Na+和4个Cl-。
答案:(1)深棕红 第四周期ⅦA族 (2) 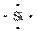 原子 SiO2+2OH-===SiO
原子 SiO2+2OH-===SiO +H2O
+H2O
(3)V型 H2S+OH-===H2O+HS-或H2S+2OH-===2H2O+S2-
(4)Mg2+ H2SO4 Mg2+[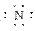 ]3-Mg2+[
]3-Mg2+[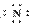 ]3-Mg2+
]3-Mg2+
(5)Na+[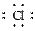 ]- Na:4个 Cl-:4个
]- Na:4个 Cl-:4个
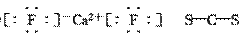
 (2)NH3 三角锥型 (3)
(2)NH3 三角锥型 (3) 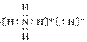 共价键、离子键
共价键、离子键