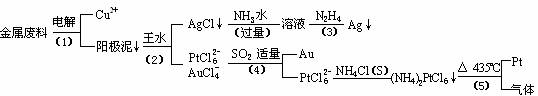
2008.3.7
高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸,将两个分别装有0.3g NaHCO3、0.3g Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3、Na2CO3同时倒入试管中,观察到现象如下:
①试管中(填产生沉淀或气体及反应速率等相关现象)
______________________________________________________
②两试管中气球大小(包含试管) 体积之比约为(填最简单整数比)(盐酸均足量)_________;
③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。类似如中和热,甲同学写出了下列热化学方程式(其中“aq”代表水合或无限稀释的含义):
HCO3-(aq)+ H+(aq) =H2O(l)+ CO2(g) ;△H>0
CO32-(aq)+ 2H+(aq)= H2O(l) + CO2(g); △H<0
甲下结论的方法是否正确____________ (填正确或不正确)
⑵ 为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
|
序号 |
试剂1 |
试剂2 |
混合前温度 |
混合后最高或最低温度 |
|
① |
50mL水 |
2.5g NaHCO3固体 |
20℃ |
18.5℃ |
|
② |
50mL水 |
3.2g Na2CO3固体 |
20℃ |
23.0 ℃ |
|
③ |
35mL稀盐酸 |
含2.5g NaHCO3的饱和溶液15mL |
20℃ |
18.8℃ |
|
④ |
35mL稀盐酸 |
含3.2g Na2CO3的饱和溶液15ml水 |
20℃ |
20.6℃ |
|
⑤ |
50mL稀盐酸 |
2.5gNaHCO3固体 |
20℃ |
17.4℃ |
|
⑥ |
50mL稀盐酸 |
3.2g Na2CO3固体 |
20℃ |
23.5℃ |
请你帮助填写相关内容:
①该研究报告的题目是《________________________________________________》;
②该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为_________和__________;通过上述实验可得出多条结论,如:
a:NaHCO3的溶解是_______(吸热或放热)过程;
b:Na2CO3的饱和溶液和盐酸的反应是____________(吸热或放热)反应;
c:NaHCO3固体与稀盐酸反应的反应热约是______的热效应之和。
2008.2.21
某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
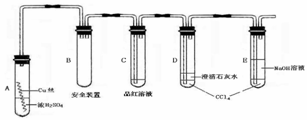
材料一:小组交流摘录
学生1:加热前,无现象发生;加热后,液面下铜丝变黑,产生气泡,有细小黑色颗粒状物质从铜丝表面进入浓硫酸中,黑色物质是什么?值得探究!
学生2:,我也观察到黑色颗粒状物质,后来逐渐转变为灰白色固体,我想该灰白色固体极有可能是未溶于浓硫酸的CuSO4。
|
材料二:探究实验剪辑
实验1 将光亮的铜丝在酒精灯火焰上灼烧变黑,然后插入稀硫酸中,铜丝重新变得光亮,溶液呈蓝绿色;将光亮的铜丝置入加热的硫蒸气中变黑,然后插入稀硫酸中无变化。
实验2 截取浓硫酸液面上方变黑的铜丝,插入稀硫酸中无变化;将浓硫酸液面下方变黑的铜丝,插入稀硫酸,黑色明显变浅,溶液呈蓝绿色。
实验3 将溶液中的黑色颗粒状物质,经过滤、稀硫酸洗、蒸馏水洗、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现质量减少10%左右。
实验选用细铜丝、98.3% H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
以下是该学习小组部分交流记录及后续探究实验的记录
根据上述材料回答下列问题
(1)A试管上方的长导管的作用是_________________;D、E两支试管中CCl4的作用是_____________。
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式:____。
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是:___ ___ 。
设计实验验证你的猜______________ 。
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是_____。(写化学式)
2008.2.24
今年是十一五开局之年,一月初党中央主持召开了全国科学大会。胡锦涛在大会报告中向全党全国人民庄严宣告,利用十五年时间把我国建设成创新型国家。同学们,请积极行动起来,充分发挥聪明才智,进行研究性学习,为将来挤身科研前沿做准备。
以下素材是某课外实验小组的实验记录,请根据实验记录回答有关问题。
实验内容:铜与硝酸反应有关问题的探讨。
实验器材:电线细铜丝,1mol•L-1HNO3,14mol•L-1HNO3,碱石灰,Cu(NO3)2晶体,
玻璃丝,酒精灯,试管,夹持器械,火柴。
实验记录如下。
|
步骤 |
实验操作 |
现象记录 |
|
1 |
将1g细铜丝放入盛有10mL1mol•L-1 HNO3的试管中加热 |
铜丝表面有无色气体逸出,溶液变成天蓝色 |
|
2 |
将1g细铜丝放入盛有10mL的14mol•L-1HNO3的试管中 |
产生大量红棕色气体,溶液变为绿色,绿色由深到浅,未见到蓝色。 |
|
3 |
将硝酸铜晶体配成饱和溶液 |
深蓝色溶液 |
|
4 |
向饱和的硝酸铜溶液中不断滴加14mol•L-1HNO3 |
溶液仍呈深蓝色 |
已知:Cu2+可以和NH3形成类似[Ag(NH3)2]+的复杂离子[Cu(NH3)4]2+,NH3分子也可以换成其他分子或离子。
请回答:
⑴稀硝酸与铜丝反应后,所得溶液呈天蓝色的化学粒子符号是 (写化学式)。
⑵使饱和硝酸铜溶液呈深蓝色的化学粒子符号可能是 。
⑶有资料上介绍浓硝酸与铜丝反应后所得溶液颜色显蓝色,实验中得到却是绿色
溶液,试写出显绿色的可能原因 ,设计两种不同的简单的实验方法证明你的解释:
方案① ;
方案② 。
2008.2.25
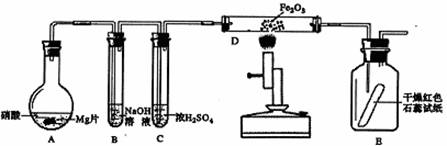
学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣。是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分解有没有催化作用?对此他们进行了实验探究。请你根据要求完成下列部分实验报告。
I 课题名称:____________________________________________________________
II实验仪器及试剂:
实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、________、________、________等。
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
III 实验步骤:略
IV 实验数据:
|
实验 编号 |
KClO3(g) |
氧化物 |
产生气体(mL) |
耗时(s) |
||
|
化学式 |
质量(g) |
回收 |
(已折算到标况) |
|||
|
1 |
0.60 |
- |
- |
- |
10 |
480 |
|
2 |
0.60 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
|
3 |
0.60 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
|
4 |
0.60 |
Fe2O3 |
0.20 |
90% |
67.2 |
34.7 |
|
5 |
0.60 |
Cr2O3 |
0.20 |
异常 |
67.2 |
188.3 |
V 实验讨论:
(1)在氧化物的回收过程中,要进行过滤操作,所用的玻璃仪器是玻璃棒、_________、________
(2)实验编号3的实验中KClO3的分解率为_________%(保留一位小数)
(3)在用Cr2O3 做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色。该刺激性气体是________(填分子式),可用______________试纸检验。上述异常现象产生的原因是___________________________________。
VI 实验结论:___________________________________________________________
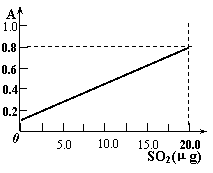 ③甲醛溶液吸收二氧化硫以后发生了如下反应,生成稳定的羟基甲磺酸:
③甲醛溶液吸收二氧化硫以后发生了如下反应,生成稳定的羟基甲磺酸: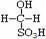
 、SO
、SO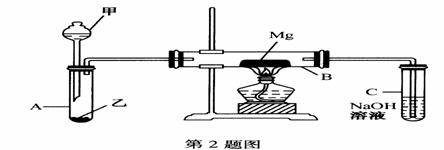
 固体
固体