网址:http://m.1010jiajiao.com/timu3_id_46093[举报]
已知:2NO2+2NaOH═NaNO3+NaNO2+H2O,NO2+NO+2NaOH═2NaNO2+H2O,且水蒸气的体积忽略不计,实验中的液体药品均过量.请回答:

(1)硝酸与Mg片反应生成的气体成分是
(2)硝酸在装置A的反应中所表现的性质有
(3)写出D中发生反应的化学方程式
| ||
| 高温高压 |
| ||
| ||
| 高温高压 |
| ||
(4)若向反应后的A中加入足量的NaOH固体,使产生的气体全部逸出,其体积为硝酸与Mg片反应生成的气体体积的
| 1 |
| 4 |
铝热反应实验如下:用两张圆形滤纸分别折叠成漏斗状,套在一起(先将置于内层的漏斗底部剪一个小孔,用水润湿),架在铁架台 的铁圈上,下面放置盛沙的蒸发皿。将适量的炒干的氧化铁粉末和铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条,引燃氧化铁和铝粉的混合物,反应剧烈进行,发出耀眼的强光,生成铁和氧化铝。
的铁圈上,下面放置盛沙的蒸发皿。将适量的炒干的氧化铁粉末和铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条,引燃氧化铁和铝粉的混合物,反应剧烈进行,发出耀眼的强光,生成铁和氧化铝。
(1)某同学为研究该实验,查阅有关资料得到如下数据:
| 物质 | Al[] | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用的试剂是 ,反应的离子方程式为 。
③实验室溶解该熔融物,下列试剂中最好的是 (填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
(2)实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价就越低。某同学
 取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4摩/升的氢氧化钠溶液,所加氢氧化钠溶液的体积(毫升)与产生的沉淀的物质的量(摩尔)的关系如下图所示。
取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4摩/升的氢氧化钠溶液,所加氢氧化钠溶液的体积(毫升)与产生的沉淀的物质的量(摩尔)的关系如下图所示。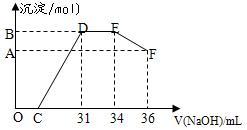
回答下列问题:
①图中OC段没有沉淀生成,此阶段发生反应的离子方程式为
②在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为
上
 述现象说明溶液中 、
述现象说明溶液中 、 、 结合OH-的能力比 强(填离子符号)。
、 结合OH-的能力比 强(填离子符号)。③B点与A点的差值为 摩尔。 查看习题详情和答案>>
(10分)某同学为研究氧化铁与过量炭粉的反应,进行如下实验:
①称取3.2 g氧化铁与2 g炭粉均匀混合,放入48.48 g的玻璃管中,按如图装置连接。
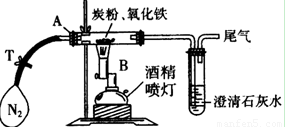
②通一段时间纯净、干燥的氮气。
③夹紧T处弹簧夹,然后点燃酒精灯,加热一段时间后,澄清石灰水变浑浊。
④完全反应后,冷却至室温,称得玻璃管和固体的总质量为52.24g。
⑴实验步骤①加入药品前,先进行的操作是 。
⑵实验步骤②通入N2的目的是 ,实验室可以用氯化铵饱和溶液和亚硝酸钠饱和溶液混合加热反应制得氮气。请写出该反应的离子方程式:_____________________________________________________________。
⑶经计算,参加反应的碳元素质量为 g。
⑷反应生成的气体是______________________,
该实验的化学方程式为:__________________________________________________。
⑸该实验设计存在不合理之处,请指出并说明改进方法 ___ ______
_______________________________________________________________________。
查看习题详情和答案>>
(10分)某同学为研究氧化铁与过量炭粉的反应,进行如下实验:
①称取3.2 g氧化铁与2 g炭粉均匀混合,放入48.48 g的玻璃管中,按如图装置连接。
②通一段时间纯净、干燥的氮气。
③夹紧T处弹簧夹,然后点燃酒精灯,加热一段时间后,澄清石灰水变浑浊。
④完全反应后,冷却至室温,称得玻璃管和固体的总质量为52.24g。
⑴实验步骤①加入药品前,先进行的操作是 。
⑵实验步骤②通入N2的目的是 ,实验室可以用氯化铵饱和溶液和亚硝酸钠饱和溶液混合加热反应制得氮气。请写出该反应的离子方程式:_____________________________________________________________。
⑶经计算,参加反应的碳元素质量为 g。
⑷反应生成的气体是______________________,
该实验的化学方程式为:__________________________________________________。
⑸该实验设计存在不合理之处,请指出并说明改进方法 ___ ______
_______________________________________________________________________。
查看习题详情和答案>>
(10分)某同学为研究氧化铁与过量炭粉的反应,进行如下实验:
①称取3.2 g氧化铁与2 g炭粉均匀混合,放入48.48 g的玻璃管中,按如图装置连接。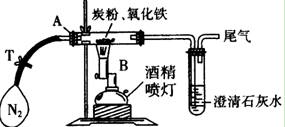
②通一段时间纯净、干燥的氮气。
③夹紧T处弹簧夹,然后点燃酒精灯,加热一段时间后,澄清石灰水变浑浊。
④完全反应后,冷却至室温,称得玻璃管和固体的总质量为52.24g。
⑴实验步骤①加入药品前,先进行的操作是 。
⑵实验步骤②通入N2的目的是 ,实验室可以用氯化铵饱和溶液和亚硝酸钠饱和溶液混合加热反应制得氮气。请写出该反应的离子方程式:_____________________________________________________________。
⑶经计算,参加反应的碳元素质量为 g。
⑷反应生成的气体是______________________,
该实验的化学方程式为:__________________________________________________。
⑸该实验设计存在不合理之处,请指出并说明改进方法 _________
_______________________________________________________________________。