26.(15分)
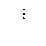
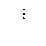 (1)丙的电子式H:C C: H(2分) 离子键、非极性共价键(2分)
(1)丙的电子式H:C C: H(2分) 离子键、非极性共价键(2分)
(2)高(1分) 水分子间存在氢键而H2S分子中不存在氢键(2分)
(3)0.2·NA或1.204×1023(2分)
|
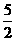 O2(g)→H2O(l)+2CO2(g);△H=-1294.8kJ·mol-1(3分)
O2(g)→H2O(l)+2CO2(g);△H=-1294.8kJ·mol-1(3分)
|
29.(16分)下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处。请用相应的化学用语回答下列问题:
|
a |
|
|
|
|
|
|
|
|
b |
 |
 |
c |
d |
e |
f |
|
|
g |
|
h |
|
|
|
i |
|
(1)写出仅由e形成的两种带有相同电荷数的阴离子的符号: 、 。
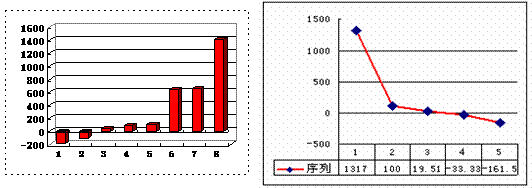
(2)上左图是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表 。(填化学式)
(3)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(上右图),序列“5”的氢化物的名称是 ,序列“2”的氢化物的结构式为 。
(4)元素a与f形成的化合物不能保存在玻璃容器中,原因是(用化学方程式表示) 。
(5)元素e与i形成的化合物是一种广谱型的消毒剂,根据世界环保联盟的要求,此化合物将逐步取代Cl2成为自来水的消毒剂,此化合物的化学式为: ,它的晶体类型是: 。
(6)a元素和d元素组成的化合物的空间构型是 (不用画图),工业上合成此化合物的适宜条件是 。
化学部分
B A C A B D C C
27.(15分)实验室可以用纯净的氯气和铁粉反应制取少量氯化铁固体,其反应装置如图所
|
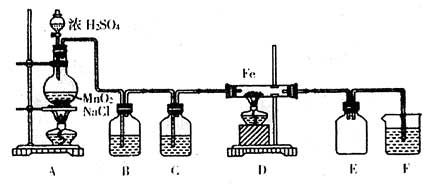
回答下列问题:
(1)该实验用NaCl固体、MnO2粉末和浓H2SO4共热来制取氯气,在实验室经常用MnO2粉末直接氧化浓HCl,请写出用MnO2粉未氧化浓HCl的反应的离子方程式
。
(2)装置B中盛放的试剂是 。
(3)装置E的作用是 。
(4)如果没有装置C,水蒸气将混入D中,铁粉与水蒸气在高温下也可反应,写出该反应的方程式
(5)装置F中反应的离子方程式是 。
(6)氯化铁固体易潮解。为防止氯化铁发生水解反应,在上述示意图中 和
之间应再接入装置 (填写A-F字母)
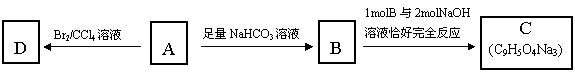
26.(15分)A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和;F元素是同周期元素中原子半径最小的主族元素。A、B、C、D、E、F形成的化合物甲、乙、丙、丁、戊、己的组成如下表所示。
|
化合物 |
甲 |
乙 |
丙 |
丁 |
戊 |
己 |
|
化学式 |
A2C |
A2C2 |
B2A2 |
D2C2 |
A2E |
DF |
回答下列问题
(1)化合物丙的电子式为 。化合物丁存在的化学键类型是 。
(2)化合物甲的沸点比戊 (填“高”或“低”),原因是
(3)向含有0.2mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数目为 个。
(4)2.0g丙完全燃烧,生成液态甲和B的气态氧化物,放出99.6KJ的热量,请写出表示丙的燃烧热的热化学方程式
(5)用铁作阳极、石墨作阴极,电解甲、己的混合溶液,电解反应的方程式为:
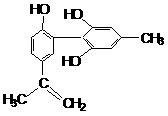 A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物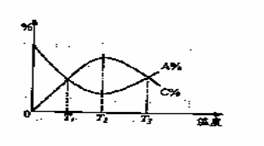 在一恒容密闭容器中,某一反应物,生成物都为气体, A、C两种物质的含量(A%. C%)随温度的变化曲线如右图所示。下列说法正确的是(
)
在一恒容密闭容器中,某一反应物,生成物都为气体, A、C两种物质的含量(A%. C%)随温度的变化曲线如右图所示。下列说法正确的是(
)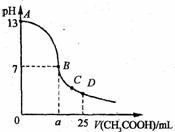 25℃时,在25 mL o.1 mol·L-1的NaOH溶液中,逐滴加入 0.2 mol·Lˉ1的CH3COOH溶液。溶液pH的变化曲线如图所示。下列分析的结论中,不正确的是
25℃时,在25 mL o.1 mol·L-1的NaOH溶液中,逐滴加入 0.2 mol·Lˉ1的CH3COOH溶液。溶液pH的变化曲线如图所示。下列分析的结论中,不正确的是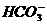 =H2O+CO2↑
=H2O+CO2↑