摘要:2.24 今年是十一五开局之年.一月初党中央主持召开了全国科学大会.胡锦涛在大会报告中向全党全国人民庄严宣告.利用十五年时间把我国建设成创新型国家.同学们.请积极行动起来.充分发挥聪明才智.进行研究性学习.为将来挤身科研前沿做准备. 以下素材是某课外实验小组的实验记录.请根据实验记录回答有关问题. 实验内容:铜与硝酸反应有关问题的探讨. 实验器材:电线细铜丝.1mol•L-1HNO3.14mol•L-1HNO3.碱石灰.Cu(NO3)2晶体. 玻璃丝.酒精灯.试管.夹持器械.火柴. 实验记录如下. 步骤 实验操作 现象记录 1 将1g细铜丝放入盛有10mL1mol•L-1 HNO3的试管中加热 铜丝表面有无色气体逸出.溶液变成天蓝色 2 将1g细铜丝放入盛有10mL的14mol•L-1HNO3的试管中 产生大量红棕色气体.溶液变为绿色.绿色由深到浅.未见到蓝色. 3 将硝酸铜晶体配成饱和溶液 深蓝色溶液 4 向饱和的硝酸铜溶液中不断滴加14mol•L-1HNO3 溶液仍呈深蓝色 已知:Cu2+可以和NH3形成类似[Ag(NH3)2]+的复杂离子[Cu(NH3)4]2+.NH3分子也可以换成其他分子或离子. 请回答: ⑴稀硝酸与铜丝反应后.所得溶液呈天蓝色的化学粒子符号是 . ⑵使饱和硝酸铜溶液呈深蓝色的化学粒子符号可能是 . ⑶有资料上介绍浓硝酸与铜丝反应后所得溶液颜色显蓝色.实验中得到却是绿色 溶液.试写出显绿色的可能原因 .设计两种不同的简单的实验方法证明你的解释: 方案① , 方案② .
网址:http://m.1010jiajiao.com/timu3_id_46095[举报]
国家环保总局“环境监测公报”中指出,减少SO2等有害气体的排放和生活废水的处理是我国“十一五”期间环境保护的主要任务.保护我们赖以生存的环境应该成为我们每个人的自觉行动.下面是一些有关大气污染及治理的问题,请回答相关的内容:
(1)分析某地几年内的降雨成分发现,前些年雨水中阴离子主要以SO2-4离子为主,近几年雨水中
离子的比例有呈明显上升的趋势.通过该地的雨水样本分析,推测该地的大气污染特征是 .
A.煤烟型
B.机动车尾气型
C.由煤烟型向煤烟型与机动车尾气混合型转化
D.由机动车尾气型向煤烟型与机动车尾气混合型转化
(2)某校研究性学习小组收集到一酸雨样本,他们将样本置于敞口容器中并对样本进行一段时间的pH值测定,其测定结果见下表:
请用化学方程式表示该地区酸雨pH随时间增加而减小的原因 .
(3)在工业上采用氨法烟气脱硫技术.其做法是用氨吸收烟气中的SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO2后的混合手中通入适量的氨气得到一种复合肥.氨水吸收SO2生成亚硫酸铵的化学方程式 .
(4)为将SO2的污染变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2和得到单质硫.该方法涉及到的化学反应有:
A.XSO2+2XCO═2xCO2+Sx
B.xCO+Sx═xCOS
C.2XCOS+xSO2═2xCO2+3Sx
其中属于氧化还原反应的是 (填字母).COS分子的电子式为 .
(5)含氮氧化物的气体可以用NH3在一定条件下进行处理,变成两种无毒的物质后排放.下列流程是探究不同催化剂对NH3还原NO反应的催化性能.

若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通过滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同).为比较不同催化剂的催化性能,需要测量并记录的数据是 .在催化剂存在下NH3还原NO的化学方程式 .
查看习题详情和答案>>
(1)分析某地几年内的降雨成分发现,前些年雨水中阴离子主要以SO2-4离子为主,近几年雨水中
| NO | - 4 |
A.煤烟型
B.机动车尾气型
C.由煤烟型向煤烟型与机动车尾气混合型转化
D.由机动车尾气型向煤烟型与机动车尾气混合型转化
(2)某校研究性学习小组收集到一酸雨样本,他们将样本置于敞口容器中并对样本进行一段时间的pH值测定,其测定结果见下表:
| 测试时间/h | 0 | 1 | 2 | 3 | 4 | 6 | 6 |
| 样本的Ph | 4.93 | 4.72 | 4.63 | 4.58 | 4.56 | 4.55 | 4.55 |
(3)在工业上采用氨法烟气脱硫技术.其做法是用氨吸收烟气中的SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO2后的混合手中通入适量的氨气得到一种复合肥.氨水吸收SO2生成亚硫酸铵的化学方程式
(4)为将SO2的污染变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2和得到单质硫.该方法涉及到的化学反应有:
A.XSO2+2XCO═2xCO2+Sx
B.xCO+Sx═xCOS
C.2XCOS+xSO2═2xCO2+3Sx
其中属于氧化还原反应的是
(5)含氮氧化物的气体可以用NH3在一定条件下进行处理,变成两种无毒的物质后排放.下列流程是探究不同催化剂对NH3还原NO反应的催化性能.

若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通过滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同).为比较不同催化剂的催化性能,需要测量并记录的数据是
国家环保总局“环境监测公报”指出,减少SO2的排放和生活废水的处理是
我国“十一五”期间环境保护的主要任务.请回答下列问题:
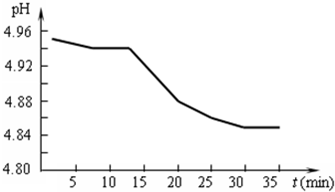 (1)SO2的排放是造成酸雨的主要因素.某地区酸雨pH随时间的变化如右图所示.请用化学方程式表示该地区酸雨pH随时间增加而减小的原因
(1)SO2的排放是造成酸雨的主要因素.某地区酸雨pH随时间的变化如右图所示.请用化学方程式表示该地区酸雨pH随时间增加而减小的原因
(2)新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应回收SO2,该技术较传统用NaOH溶液吸收及用H2SO4回收SO2处理方法的优点是
(3)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2.该方法涉及到的化学反应为:SO2+2CO=2CO2+
Sx、CO+
Sx=COS、2COS+SO2=2CO2+
Sx.其中COS(羰基硫)分子的电子式为
 .
.
(4)生活污水中含大量细小的悬浮物,可加入某些物质使之聚集成较大的颗粒而沉淀.请你举一种常见的能使生活污水中悬浮物聚沉的物质,其化学式为
查看习题详情和答案>>
我国“十一五”期间环境保护的主要任务.请回答下列问题:
 (1)SO2的排放是造成酸雨的主要因素.某地区酸雨pH随时间的变化如右图所示.请用化学方程式表示该地区酸雨pH随时间增加而减小的原因
(1)SO2的排放是造成酸雨的主要因素.某地区酸雨pH随时间的变化如右图所示.请用化学方程式表示该地区酸雨pH随时间增加而减小的原因2H2SO3+O2=2H2SO4
2H2SO3+O2=2H2SO4
.(2)新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应回收SO2,该技术较传统用NaOH溶液吸收及用H2SO4回收SO2处理方法的优点是
既能回收利用SO2,又能得到复合肥磷铵
既能回收利用SO2,又能得到复合肥磷铵
.(3)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2.该方法涉及到的化学反应为:SO2+2CO=2CO2+
| 1 |
| x |
| 1 |
| x |
| 3 |
| x |


(4)生活污水中含大量细小的悬浮物,可加入某些物质使之聚集成较大的颗粒而沉淀.请你举一种常见的能使生活污水中悬浮物聚沉的物质,其化学式为
KAl(SO4)2?12H2O或 FeSO4?7H2O
KAl(SO4)2?12H2O或 FeSO4?7H2O
.若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后在该酸性溶液中加入甲醇,NO3-和甲醇转化为两种无毒气体.请写出加入甲醇后反应的离子方程式6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O
6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O
.中国“十一五”规划纲要提出节能减排(指的是减少能源浪费和降低废气排放),这是贯彻落实科学发展观、构建社会主义和谐社会的重大举措;是建设资源节约型、环境友好型社会的必然选择;是推进经济结构调整,转变增长方式的必由之路;是维护中华民族长远利益的必然要求.请你分析并回答下列问题:
(1)“绿色化学”的最大特点在于它是在始端就采用预防实际污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”.下列化学反应不符合“绿色化学”思想的是 .
A.制备环氧乙烷:2CH2=CH2+O2
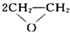
B.制备硫酸铜:Cu+2H2SO4
CuSO4+SO2↑+2H2O
C.制备甲醇:2CH4+O2
2CH3OH
D.制备硝酸铜:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)冶金废水中含有[Au(CN)2],其电离出的CN-有毒,当与H+结合生成HCN时,其毒性更强.工业上处理这种废水是在碱性条件下,用NaClO将CN-氧化为CO32-和一种无毒气体,该反应的方程式为 ,在酸性条件下,ClO-也能将CN-氧化,但实际处理时却不在酸性条件下进行的主要原因是 .
(3)工业上目前使用两种方法制取乙醛--“乙炔水化法”和“乙烯氧化法”.下面两表提供生产过程中原料、反应条件、原料平衡转化率和产量等的有关信息:
表一:原料、反应条件、平衡转化率、日产量
表二:原料来源生产工艺
从两表中分析,现代工业上“乙烯氧化法”将逐步取代“乙炔水化法”的可能原因.
①从产率和产量角度分析 .
②从环境保护和能耗角度分析 .
查看习题详情和答案>>
(1)“绿色化学”的最大特点在于它是在始端就采用预防实际污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”.下列化学反应不符合“绿色化学”思想的是
A.制备环氧乙烷:2CH2=CH2+O2
| 催化剂 |
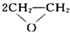
B.制备硫酸铜:Cu+2H2SO4
| ||
C.制备甲醇:2CH4+O2
| 催化剂 |
| 加热加压 |
D.制备硝酸铜:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)冶金废水中含有[Au(CN)2],其电离出的CN-有毒,当与H+结合生成HCN时,其毒性更强.工业上处理这种废水是在碱性条件下,用NaClO将CN-氧化为CO32-和一种无毒气体,该反应的方程式为
(3)工业上目前使用两种方法制取乙醛--“乙炔水化法”和“乙烯氧化法”.下面两表提供生产过程中原料、反应条件、原料平衡转化率和产量等的有关信息:
表一:原料、反应条件、平衡转化率、日产量
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| 原料生产工艺过程 | ||||||||
| 乙炔 | CaCO3
| |||||||
| 乙烯 | 来源于石油裂解气 |
①从产率和产量角度分析
②从环境保护和能耗角度分析
国家环保总局“2006年环境监测公报”指出,减少SO2的排放和生活废水的处理是我国“十一五”期间环境保护的主要任务。
请回答下列问题:
(1)SO2的排放是造成酸雨的主要因素。某地区酸雨pH随时间的变化如下图所示。请用化学方程式表示该地区酸雨pH随时间增加而减小的原因______________________________。

(2)新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO2后的混合物中通入适量的氨气得到一种产品。该技术的优点是_______________________________________________________。
(3)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及的化学反应为:SO2+2CO====2CO2+![]() Sx、CO+
Sx、CO+![]() Sx====COS、2COS+SO2====2CO2+
Sx====COS、2COS+SO2====2CO2+![]() Sx。其中COS分子的空间构型为______________。
Sx。其中COS分子的空间构型为______________。
(4)生活污水中含大量细小的悬浮物,可加入某些物质使之聚集成较大的颗粒而沉淀。请你举一种常见的能使生活污水中悬浮物聚沉的物质,其化学式为_____________。若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在硝化细菌的作用下将![]() 氧化为
氧化为![]() :
:![]() +2O2====
+2O2====![]() +2H++H2O,然后加入甲醇,
+2H++H2O,然后加入甲醇,![]() 和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式__________________________。
和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式__________________________。