摘要:2.27 已知SiO.SO和CO都是酸性氧化物.化学性质具有一定的相似性,Mg和Na的化学性质也具有一定相似性. Ⅰ.用如图所示装置进行Mg与SO反应的实验. (1)选择制取SO的合适试剂 . ①10%的H2SO4溶液 ②80%的H2SO4溶液 ③Na2SO3固体 ④ CaSO固体 (2)写出装置B中发生的主要反应的化学方程式 .装置C中NaOH溶液 的作用是 . (3)你认为该装置是否有不足之处? .如果有.请一一说明 . Ⅱ.某研究小组进行了“实验室制Si 的研究.它们以课本为基础.查阅资料得到以下可供参考的信息: ①业上在高温时用C还原SiO2可制得Si ②Mg在点燃的条件下即可与SiO2反应 ③金属硅化物与稀H2SO4反应生成硫酸盐与SiH4 ④Si和SiO2均不与稀H2SO4反应 ⑤SiH4在空气中自然 他们在研究报告中记载着“--选用合适的物质在适宜的条件下充分反应,再用足量稀硫酸溶解固体产物,然后过滤.洗涤.干燥,最后称量--在用稀硫酸溶解固体产物时.发现有爆鸣声和火花.其产率也只有预期值的63%左右 . (1)该小组“实验室制Si 的化学方程式是 . (2)你估计“用稀硫酸溶解固体产物时.发现有爆鸣声和火花 的原因是 .
网址:http://m.1010jiajiao.com/timu3_id_46092[举报]
工业上由金红石(TiO2)制取单质Ti,涉及的步骤为:
TiO2
TiCl4
Ti
(1)写出步骤ⅡTiCl4→Ti的化学方程式
(2)已知:①C(s)+O2(g)=CO2(g),△H=-393.5kJ?mol-1
②2CO+O2(g)=2CO2(g),△H=-566kJ?mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g),△H=+141kJ?mol-1
则反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H=
查看习题详情和答案>>
TiO2
| 步骤Ⅰ |
| Mg,800℃,Ar |
| 步骤II |
(1)写出步骤ⅡTiCl4→Ti的化学方程式
2Mg+TiCl4
Ti+2MgCl2
| ||
| Ar |
2Mg+TiCl4
Ti+2MgCl2
.
| ||
| Ar |
(2)已知:①C(s)+O2(g)=CO2(g),△H=-393.5kJ?mol-1
②2CO+O2(g)=2CO2(g),△H=-566kJ?mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g),△H=+141kJ?mol-1
则反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H=
-80
-80
kJ?mol-1.(1)某温度下,纯水的c(H+)=2×10-7mol?L-1,则此时c(OH-)为
(2)已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
①C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
②H2(g)+
O2(g)═H2O(g)△H2=-242.0kJ/mol
③CO(g)+
O2(g)═CO2(g)△H3=-283.0kJ/mol
写出C(s)与水蒸气反应生成CO和H2的热化学方程式:
(3)在25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
(4)常温下,0.1 mol?L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)
(5)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应完成后溶液中c(NH4+)=c(Cl-),则溶液显
查看习题详情和答案>>
2×10-7 mol?L-1
2×10-7 mol?L-1
;若温度不变,滴入稀盐酸使c(H+)=5×10-4mol?L-1则溶液中c(OH-)为8×10-11mol?L-1
8×10-11mol?L-1
,由水电离产生的c(H+)为8×10-11mol?L-1
8×10-11mol?L-1
,此时温度高于
高于
(填“高于”、“低于”或“等于”25℃)(2)已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
①C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
②H2(g)+
| 1 |
| 2 |
③CO(g)+
| 1 |
| 2 |
写出C(s)与水蒸气反应生成CO和H2的热化学方程式:
C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ/mol
C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ/mol
.(3)在25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
Cu(OH)2
Cu(OH)2
沉淀(填化学式),生成该沉淀的离子方程式为2NH3?H2O+Cu2+=Cu(OH)2↓+2NH4+
2NH3?H2O+Cu2+=Cu(OH)2↓+2NH4+
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20).(4)常温下,0.1 mol?L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)
>
>
c(CO32-)(填“>”、“=”或“<”).(5)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应完成后溶液中c(NH4+)=c(Cl-),则溶液显
中
中
性(填“酸”“碱”或“中”),a>
>
0.01mol?L-1(填“>”、“=”或“<”).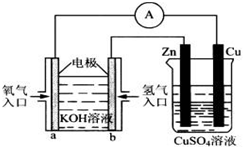 Ⅰ.用碳棒作电极,电解下列水溶液:①Na2SO4溶液 ②AgNO3溶液 ③KCl溶液 ④CuCl2溶液.通过相同电量时,阴极产生的气体物质的量相同的是(填序号)
Ⅰ.用碳棒作电极,电解下列水溶液:①Na2SO4溶液 ②AgNO3溶液 ③KCl溶液 ④CuCl2溶液.通过相同电量时,阴极产生的气体物质的量相同的是(填序号)Ⅱ.到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)化学反应中放出的能量(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2(g)+Cl2(g)=2HCl(g)△H=-185KJ/mol
E(H-H)=436KJ/mol,E(Cl-Cl)=247KJ/mol,则E(H-Cl)=
(2)已知Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25KJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47KJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19KJ/mol
请写出CO还原FeO的热化学方程式:
(3)如图所示的装置:该装置中Cu极为
(2011?东城区二模)为了减少煤燃烧对大气造成的污染,煤的气化和液化是高效、清洁利用煤炭的重要途径,而减少CO2气体的排放也是人类面临的重大课题.煤综合利用的一种途径如下所示: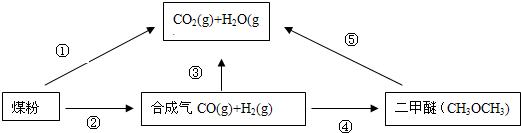
(1)用图所示装置定量检测过程①产生的CO2(已知:煤粉燃烧过程中会产生SO2)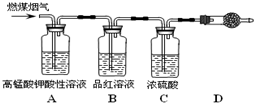
B中预期的实验现象是
(2)已知C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.3kJ?mol-1
C(s)+2H2O(g)=CO2(g)+2H2(g)△H2=+90kJ?mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是
(3)用图装置可以完成⑤的转化,同时提高能量的利用率.其实现的能量转化形式主要是
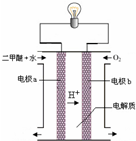
(4)燃煤烟气中的CO2可用稀氨水捕获和吸收,不仅可以减少CO2的排放,也可以生产化肥碳酸氢铵.假设该方法每小时处理含CO2的体积分数为11.2%的燃煤烟气1000m3(标准状况),其中CO2的脱除效率为80%,则理论上每小时生产碳酸氢铵
查看习题详情和答案>>

(1)用图所示装置定量检测过程①产生的CO2(已知:煤粉燃烧过程中会产生SO2)

B中预期的实验现象是
品红溶液不变色
品红溶液不变色
,D中的试剂是碱石灰
碱石灰
.(2)已知C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.3kJ?mol-1
C(s)+2H2O(g)=CO2(g)+2H2(g)△H2=+90kJ?mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.3kJ?mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.3kJ?mol-1
,该反应的化学平衡常数K随温度的升高将减小
减小
(填“增大”、“减小”或“不变”).(3)用图装置可以完成⑤的转化,同时提高能量的利用率.其实现的能量转化形式主要是
化学能转化为电能
化学能转化为电能
,a的电极反应式是CH3OCH3+3H2O-12e-=2CO2↑+12H+
CH3OCH3+3H2O-12e-=2CO2↑+12H+
.
(4)燃煤烟气中的CO2可用稀氨水捕获和吸收,不仅可以减少CO2的排放,也可以生产化肥碳酸氢铵.假设该方法每小时处理含CO2的体积分数为11.2%的燃煤烟气1000m3(标准状况),其中CO2的脱除效率为80%,则理论上每小时生产碳酸氢铵
316
316
kg.
(1)某温度下,纯水的c(H+)=2×10-7mol?L-1,则此时c(OH-)为 ;若温度不变,滴入稀盐酸使c(H+)=5×10-4mol?L-1则溶液中c(OH-)为 ,由水电离产生的c(H+)为 ,此时温度 (填“高于”、“低于”或“等于”)25℃.
(2)已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
①C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
②H2(g)+
O2(g)═H2O(g)△H2=-242.0kJ/mol
③CO(g)+
O2(g)═CO2(g)△H3=-283.0kJ/mol
写出C(s)与水蒸气反应生成CO和H2的热化学方程式: .
(3)常温下,取物质的量浓度相同的NaOH和HCl溶液,以3:2体积比相混合,所得混合液的pH=12,则原溶液的物质的量浓度为 .(溶液体积变化忽略不计)
(4)常温下,0.l mol?L-1NaHCO3溶液的pH大于7,用离子方程式表示其原因 .
查看习题详情和答案>>
(2)已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
①C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
②H2(g)+
| 1 |
| 2 |
③CO(g)+
| 1 |
| 2 |
写出C(s)与水蒸气反应生成CO和H2的热化学方程式:
(3)常温下,取物质的量浓度相同的NaOH和HCl溶液,以3:2体积比相混合,所得混合液的pH=12,则原溶液的物质的量浓度为
(4)常温下,0.l mol?L-1NaHCO3溶液的pH大于7,用离子方程式表示其原因