27、(11分)运用化学反应原理研究碳的氧化物的性质具有重要意义。
(1)CO2是一种重要的物质,但其过量排放,可能导致全球气温升高。下列措施不能够有效控制CO2所导致的温室效应的是________(填序号)
①大力发展低碳产业,提倡低碳生活,依法控制CO2的过量排放
②禁止滥砍滥伐,植树造林,恢复生态
③开发利用各种新型能源代替煤、石油、天然气等化石能源
④提倡使用脱硫煤、无铅汽油等清洁燃料
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7 ,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka =4.7×10-8。写出往84消毒液中通入二氧化碳发生反应的离子方程式 。
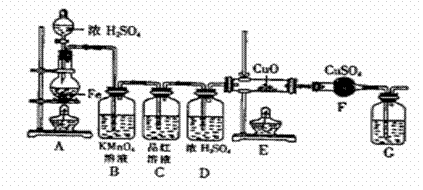
(3)CO具有还原性,某同学设计图示装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应。
|
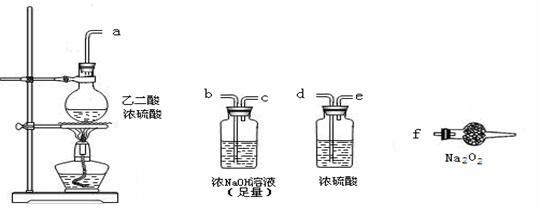
已知:H2C2O4====== CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为 ;
若CO能够与Na2O2发生反应,则预测反应产物为 。实验后用球形干燥管中的固体进行产物验证可选择的试剂是 。
(4)已知①C(s)+ O2(g)=CO2(g),△H=-393.5 kJ·mol -1 ;
②CO(g)+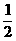 O2(g)=CO2(g),△H=-283.0 kJ·mol -1,
O2(g)=CO2(g),△H=-283.0 kJ·mol -1,
写出CO2 和C(s)反应的热化学方程式 ;
(5)以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸钠,工作时负极反应式为 ,若使用该电池电解饱和食盐水制取1molNaOH,则理论上需要氧气的体积为(标准状况下) L。
26、(8分)(1)已知:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2(g),ΔH=-247kJ/mol
CH3OCH3(g) + CO2(g),ΔH=-247kJ/mol
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 .
A.低温高压 B.加入催化剂 C.体积不变充入氦气 D.增加CO的浓度 E.分离出二甲醚
(2) 已知反应2CH3OH(g)
 CH3OCH3(g) + H2O(g),在某温度下,在1L密闭容器中加入CH3OH ,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
CH3OCH3(g) + H2O(g),在某温度下,在1L密闭容器中加入CH3OH ,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L-1) |
0.01 |
0.2 |
0.2 |
①该反应的平衡表达式K= ,该温度的平衡常数为 。
② 若加入CH3OH后,经10 min反应达到平衡,该时间内反应速率v(CH3OH) = 。
若平衡后,再向容器中再加入0.01mol CH3OH和0.2mol CH3OCH3,此时正、逆反应速率的大小:
v正 v逆 (填“>”、“<”或“=”)。
 ②若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是_________
(用元素符号表示)
②若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是_________
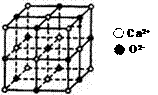
(用元素符号表示)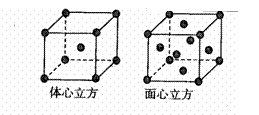 (3)CaO晶胞如右图所示其中Ca2+的配位数为
,CaO晶体和NaCl晶体的离子排布方式相同,CaO晶体的熔点高于NaCl晶体的熔点的主要原因是
。
(3)CaO晶胞如右图所示其中Ca2+的配位数为
,CaO晶体和NaCl晶体的离子排布方式相同,CaO晶体的熔点高于NaCl晶体的熔点的主要原因是
。
 二氧化氯时,转移电子
二氧化氯时,转移电子