30. [选修-物质结构与性质](13分)
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
|
A |
|
|
|||||||||||||||
|
B |
|
|
|
C |
D |
E |
F |
|
|||||||||
|
G |
H |
I |
J |
|
K |
L |
|
||||||||||
|
|
|
|
|
|
M |
|
|
N |
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)请写出元素N的基态原子电子排布式 。
(2)元素B、G形成的单质熔点更高的是_______(填化学式),原因是_________________________
(3)ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是__________(填“极性”或“非极性”)分子。
(4)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有___________(填序号),CS2分子的空间构型是__________。
(5)元素N可以形成分子式为Co(NH3)5BrSO4,配位数均为6的两种配合物,若往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则该配合物的化学式为 。
25.(16分)向草酸(H2C2O4)溶液中逐滴加入酸性高锰酸钾溶液反应时,溶液褪色总是先慢后快。为了探究此反应速率由小变大的原因,设计如下实验
已知:①MnO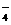 在酸性环境下的还原产物是Mn2+;
在酸性环境下的还原产物是Mn2+;
②草酸是二元弱酸,有毒,温度较高时分解。
(1)0.10mol/L H2C2O4溶液的配制:K^S*5U.C#O
实验室欲配制100mL 0.10mol/L H2C2O4 溶液,需要用托盘天平称取草酸晶体(H2C2O4·2H2O) g;实验中需要用到的玻璃仪器除了玻璃棒、胶头滴管外还有: 。(填代号)
(2)反应速率变化的探究
取4支试管,按以下四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化均如下:紫红色→红色→橙红色→橙色→黄色→无色,但溶液褪为无色所需的时间不同,如下表所示:(表中“-”表示未加入该试剂)
|
实验 编号 |
温度(利用水浴加热) |
0.10mol/L 草酸溶液 |
稀硫酸 溶液 |
MnSO4固体 |
0.10 mol/L KMnO4溶液 |
褪色 时间 |
|
1 |
65℃ |
5mL |
- |
- |
1mL |
100s |
|
2 |
65℃ |
5mL |
10滴 |
- |
1mL |
90s |
|
3 |
75℃ |
5mL |
10滴 |
- |
1mL |
40s |
|
4 |
75℃ |
5mL |
10滴 |
加入少许 |
1mL |
3s |
①H2C2O4溶液与酸性的KMnO4溶液反应的离子方程式为 ;
②设计对比实验1、2的目的是:_____________________________________________ ;
③由表中数据可以得出,温度对该化学反应速率的影响是:________________________;
为了加快该反应的反应速率,是不是水浴的温度越高越好?_______(填“是”或“否”);
④由以上4个实验,还可以得出的一个结论是:_____________________________
⑤若为了探究浓度对该反应速率的影响,则在所设计的实验中最好是增大________(填“草酸”或“高锰酸钾”)溶液的浓度,以减少实验误差。
7.已知:含碳碳双键的物质( 如烯烃)一定条件下能与水发生加成反应,生成醇(含羟基的烃的衍生物);有机物A-D间存在图示的转化关系。下列说法正确的是
如烯烃)一定条件下能与水发生加成反应,生成醇(含羟基的烃的衍生物);有机物A-D间存在图示的转化关系。下列说法正确的是
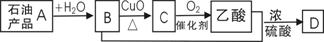
A.D结构简式为CH3C-O-OCH2CH3
B.A能使酸性高锰酸钾溶液褪色,不能使溴水因反应而褪色
|
 D.C转化为乙酸的化学方程式为:CH3CHO+O2
CH3COOH
D.C转化为乙酸的化学方程式为:CH3CHO+O2
CH3COOH
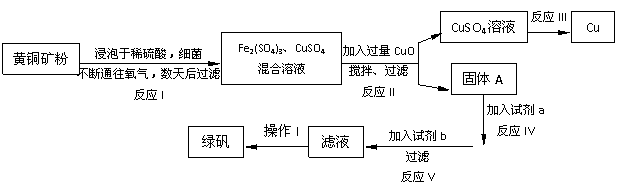 某工厂运用该原理生产铜和绿矾(FeSO4·7H2O)的工艺如下:
某工厂运用该原理生产铜和绿矾(FeSO4·7H2O)的工艺如下: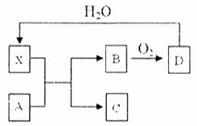 已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如下图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是:
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如下图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是: