5、若某电能与化学能的转化装置(电解池或原电池)中发生反应的总反应离子方程式是: Cu+2H+=Cu2++H2↑,则关于该装置的有关说法正确的是 ( )
A.该装置可能是原电池,也可能是电解池
B.该装置只能是原电池,且电解质溶液为硝酸
C.该装置只能是电解池,电解质溶液不可能是盐酸
D.该装置只能是电解池,且金属铜为该电解池的阳极
|
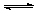 2CO32-+ 6H2O,则下列说法正确的是 ( )
2CO32-+ 6H2O,则下列说法正确的是 ( )
A.放电时CH3OH参与反应的电极为正极
B.放电时负极的电极反应为:CH3OH
- 6e- + 8OH- CO32-+6H2O
CO32-+6H2O
C.标准状况下,通入5.6LO2,并完全反应后,有0.5mol电子转移
D.放电一段时间后,通入O2的电极附近溶液的pH降低
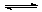 Fe(OH)2+ Ni(OH)2下列对爱迪生蓄电池推断错误的是
( )
Fe(OH)2+ Ni(OH)2下列对爱迪生蓄电池推断错误的是
( ) ⑤ 蓄电池的电极必须浸入某种碱性电解质溶液中
⑤ 蓄电池的电极必须浸入某种碱性电解质溶液中 LaNi5+6Ni(OH)下列说法正确的是
( )
LaNi5+6Ni(OH)下列说法正确的是
( ) 实验时,关闭c,打开b和a;从分液漏斗内向A中加过量的稀盐酸;
实验时,关闭c,打开b和a;从分液漏斗内向A中加过量的稀盐酸;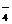 +H2C2O4+H+®CO2+Mn2++H2O MnO
+H2C2O4+H+®CO2+Mn2++H2O MnO SO2++SO
SO2++SO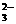 ,在液态SO2中可用Cs2SO3去滴定SOCl2 ,发生的反应方程式为:
,在液态SO2中可用Cs2SO3去滴定SOCl2 ,发生的反应方程式为: NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式
NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式