网址:http://m.1010jiajiao.com/timu3_id_384333[举报]
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
(1)取23.4克NaCl和40.4克KNO3,加70.0克H2O,加热溶解.在100℃时蒸发掉50.0克H2O,维持该温度,过滤出晶体,计算所得晶体的质量(m高温).将滤液冷却至10℃,待充分结晶后,过滤.计算所得晶体的质量(m低温).
(2)另取34.0克NaNO3和29.8克KCl,同样进行如上实验.10℃时析出的晶体是
(1)在25℃时,1L水中约能溶解0.01g碳酸钡,则该温度下碳酸钡的溶度积Ksp=
(2)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,应选用
判断到达滴定终点的实验现象是
(3)为测定某烧碱样品中NaOH的含量(设样品中杂质为Na2CO3),某同学进行如下实验:准确称取5.0g样品配制成250mL溶液,然后分三次各取配制好的烧碱溶液20.00mL于三个用蒸馏水洗净的锥形瓶中,分别加入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol?L-1的盐酸标准液进行滴定,相关数据记录如表
| 实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
| 初读数 | 末读数 | ||
| 1 | 20.00 | 0.00 | 31.00 |
| 2 | 20.00 | 1.00 | 32.04 |
| 3 | 20.00 | 1.10 | 32.18 |
②滴定时的正确操作是
③下列操作会导致烧碱样品中NaOH含量测定值偏高的是
A.锥形瓶用蒸馏水洗后未用待测液润洗
B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.在滴定前有气泡,滴定后气泡消失
D.滴定前平视读数,滴定结束俯视读数.
(1)A为0.1mol/L的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为
(2)B为0.1mol/L NaHCO3溶液,请分析NaHCO3溶液显碱性的原因:
- 3 |
- 3 |
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时常加入
- 3 |
- 3 |
(4)D为含有足量AgCl固体的饱和溶液,AgCl在水中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq),在25℃时,氯化银的Ksp=1.8×10-10.现将足量氯化银分别放入:
①100mL蒸馏水中;②100mL 0.2mol/L AgNO3溶液中;③100mL 0.1mol/L氯化铝溶液中;④100mL 0.1mol/L盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是
(5)E为CuSO4溶液,已知25℃时,Ksp[Cu(OH)2]=2×10-20.要使0.2mol?L-1 E溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为
(8分)现使用酸碱中和滴定法测定市售白醋的总酸量(g/100 mL)。
Ⅰ.实验步骤:
(1)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL________(填仪 器名称)中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴________作指示剂。
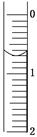
(3)读取盛装0.100 0 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________ mL。
(4)滴定。当____________________ ________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录:
|
滴定次数 实验数据(mL) |
1 |
2 |
3 |
4 |
|
V(样品) |
20.00 |
20.00 |
20.00 |
20.00 |
|
V(NaOH)(消耗) |
15.95 |
15.00 |
15.05 |
14.95 |
Ⅲ.实验处理:
(1)某同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=(15.95+15.00+15.05+14.95)/4 mL=15.24 mL。
指出他的计算的不合理之处:____________ _ _。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号)________。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看习题详情和答案>>
(8分)(2010·石家庄质量检测)在一密闭容器中发生反应N2+3H2 2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示: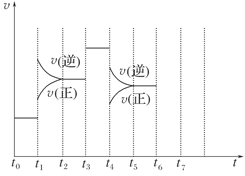
回答下列问题:
(1)处于平衡状态的时间段是________(填选项)。
A.t0~t1 B.t1~t2 C.t2~t3
D.t3~t4 E.t4~t5 F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是(填选项)
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
t1时刻________;t3时刻________;t4时刻________。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是________(填选项)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。
(5)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为________。