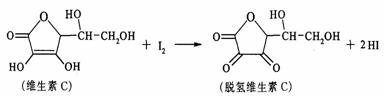
25. 实验室用丁酸和乙醇为原料,在浓硫酸存在的条件下加热制取并分离出丁酸乙酯,反应方程式及有关信息如下:
实验室用丁酸和乙醇为原料,在浓硫酸存在的条件下加热制取并分离出丁酸乙酯,反应方程式及有关信息如下:
CH3CH2OH+CH3CH2 CH2COOH CH3CH2CH2COOC2H5+H2O
反应在该条件下进行时各物质的浓度(mol/L)随时间的变化如下表:
|
时间(min) |
CH3CH2 CH2COOH |
CH3CH2OH |
CH3CH2CH2COOC2H5 |
H2O |
|
0 |
0.3 |
0.7 |
0 |
0.3 |
|
10 |
0.23 |
a |
b |
c |
|
20 |
0.2 |
0.6 |
0.1 |
0.4 |
有关物质在101.3K Pa时沸点如下:
|
物质 |
乙醇 |
丁酸 |
丁酸乙酯 |
水 |
油 |
|
沸点(ºC) |
78.5 |
163.5 |
121-126 |
100 |
约250 |
(1) 写出该反应的平衡常数表达式K=______________________________。
能否由题给条件判断K值随温度变化是增大还是减小___________(选填“能”或“不能”)。
(2)表中,a = ____ mol/L。50℃时,K=,在20min时,反应是否达到平衡______(选填“是”或“否”)。
(3)在10~20min时,用乙醇表示的平均反应速率为_______________mol/L·min。
该反应速率比0~10min的平均反应速率小,其原因是_______________________。
(4)在起始浓度相同的情况下,要提高丁酸乙酯的产率,可采取的措施是__________________________________________________________________________。
23.(B)下表是元素周期表
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
① |
|
② |
|
|
|
③ |
|
|
|
|
|
|
|
|
|
|
④ |
⑤ |
|
⑥ |
⑦ |
⑧ |
|
⑨ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑩ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)⑤的元素符号是______;在上述周期表用元素符号标出铁元素所在的位置。
(2)表中最活泼的金属是______,非金属性最强的元素是______;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是_______,分别写出该元素的氢氧化物与⑨的最高价氧化物对应水化物反应的化学方程式: __________________________________________;
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱: ______________________________________________________________________。
|
产品标准 |
GB5461 |
|
产品等级 |
一级 |
|
配 料 |
食盐、碘酸钾、抗结剂 |
|
碘含量(以I计) |
20~50mg/kg |
|
分装时期 |
|
|
分装企业 |
|
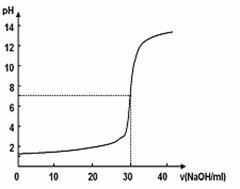
22.如图所示,10mL物质的量浓度为x mol/L的盐酸,用物质的量浓度为y mol/L的NaOH溶液滴定的图示。依据图示推出x和y的物质的量浓度是( )
|
|
A |
B |
C |
D |
|
x (mol/L) |
0.12 |
0.04 |
0.03 |
0.09 |
|
y(mol/L) |
0.04 |
0.12 |
0.09 |
0.03 |
第II卷(共84分)
 C.NH4+ 的数目 D.NH4+的浓度
C.NH4+ 的数目 D.NH4+的浓度