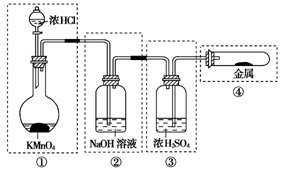
6.(2008年北京东城二摸)已知:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O。如下图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是 ( )
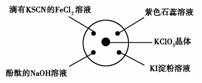
|
选项 |
实验现象 |
结论 |
|
A |
滴有KSCN的FeCl2溶液变红 |
Cl2具有还原性 |
|
B |
滴有酚酞的NaOH溶液褪色 |
Cl2具有酸性 |
|
C |
石蕊溶液先变红后褪色 |
Cl2具有漂白性 |
|
D |
淀粉KI溶液中变蓝 |
Cl2具有氧化性 |
[解析] A项说明Cl2具有氧化性。B项是Cl2先与H2O反应生成了酸。C项是Cl2与H2O反应生成的HClO具有漂白性。D项的反应为Cl2+2KI===2KCl+I2,说明Cl2具有氧化性。
[答案] D


 Al(OH)3+3H+
Al(OH)3+3H+