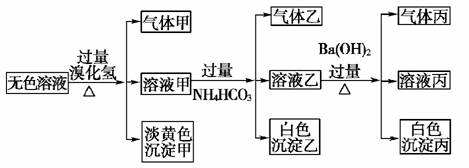
13.(2007年全国Ⅰ理综)A、B、C、D、E均为可溶于水的固体,组成它们的离子有
|
阳离子 |
Na+ Mg2+ Al3+ Ba2+ |
|
阴离子 |
OH- Cl- CO SO HSO |
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。
据此推断它们是:
A______;B________;C________;D________;E________。
[解析] 解决本题的突破口在于④即B中加适量D有白色沉淀生成,加过量D沉淀量减少,所以B中含Al3+,D中含OH-,但加过量D时沉淀并不消失,D不能为NaOH,只能为Ba(OH)2,从而推断出B为Al2(SO4)3。结合①、②、③,A可和三种物质生成沉淀,推断A只能为Na2CO3。①、②中的沉淀均可溶于E溶液,E中的阴离子应为HSO,结合生成的白色沉淀能溶于E,阳离子可能为Na+或Mg2+,所以E为NaHSO4或Mg(HSO4)2。熟记溶解性表是解决本题的关键,也是解决离子共存问题、书写离子方程式等问题的必备知识。
[答案] Na2CO3 Al2(SO4)3 MgCl2 Ba(OH)2
NaHSO4[Mg(HSO4)2]
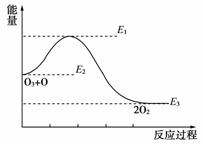
 B.反应①中的能量变化如右图所示
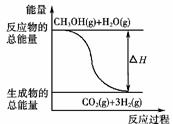
B.反应①中的能量变化如右图所示

 Si(s)+4HCl(g);ΔH=+Q kJ/mol(Q>0)
Si(s)+4HCl(g);ΔH=+Q kJ/mol(Q>0)