摘要:10.已知H2(g)+Br2 ΔH=-72 kJ/mol.蒸发1 mol Br2(l)需要吸收的能量为30 kJ.其他数据如下表: H2(g) Br2(g) HBr(g) 1 mol分子中的化学键 断裂时需要吸收的能量/Kj 436 a 369 则表中a为( ) A.404 B.260 C.230 D.200 解析:1 mol H2(g)与1 mol Br2(g)完全反应生成2 mol HBr(g)的ΔH1=-(369×2-436-a)=-(302-a) kJ/mol 则ΔH=ΔH2+ΔH1 即-72 kJ/mol=+30 kJ/mol+[-(302-a)kJ/mol] =30 kJ/mol-302 kJ/mol+a a=200 答案:D
网址:http://m.1010jiajiao.com/timu3_id_84920[举报]
氢能以其洁净、高效、高热值、环境友好等特点成为最有前途的新能源,制氢和储氢方法很多.
(1)直接热分解法制氢
①属于吸热反应的是: (选填:A、B、C、D)
②某温度下,H2O(g)?H2(g)+
O2(g),平衡常数K= (用含K1、K2、K3、K4表达)
(2)热化学循环制氢
已知:Br2(g)+CaO(s)→CaBr2(s)+
O2(g)△H=-73kJ/mol
3FeBr2(s)+4H2O(g)→Fe3O4(s)+6HBr(g)+H2(g)△H=384kJ/mol
CaBr2(s)+H2O(g)→CaO(s)+2HBr(g)△H=212kJ/mol
Fe3O4(s)+8HBr(g)→Br2(g)+3FeBr2(s)+4H2O(g)△H=-274kJ/mol
则H2O(g)?H2(g)+
O2(g),△H= KJ/mol
(3)光电化学分解制氢,其原理如图1.
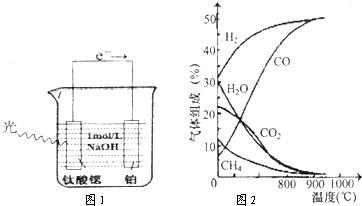
钛酸锶光电极的电极反应为4OH一+4hv-O2+2H2O,则铂电极的电极反应为 .
(4)生物质制氢,若将生物质气化炉中出来的气体[主要有CH4、CO2、H2O(g)、CO及H2]在1.0 1×105Pa下,进入转换炉,改变温度条件,各成分的体积组成关系如图2所示.下列有关图象的解读正确的是 .
A.利用CH4与H2O(g)及CO2转化为合成气CO和H2理论上是可行的
B.CH4(g)+CO2(g)→2CO(g)+2H2(g)和CH4(g)+H2O(g)→CO(g)+3H2(g),都是放热反应
C.CH4与CO2及H2O(g)转化为合成气CO和H2适宜温度约900℃
D.图象中曲线的交点处表示反应达到平衡
(5)LiBH4由于具有非常高的储氢能力,分解时生成氢化锂和两种单质,试写出反应的化学方程式 .
查看习题详情和答案>>
(1)直接热分解法制氢
| 序号 | 分解水的过程 | 平衡常数 | T=2500K | T=3000K |
| A | H2O(g)?HO(g)+H(g) | K1 | 1.34×10-4 | 8.56×10-3 |
| B | HO(g)?H(g)+O(g) | K2 | 4.22×10-4 | 1.57×10-2 |
| C | 2H(g)?H2(g) | K3 | 1.52×103 | 3.79×10 |
| D | 2O(g)?O2(g) | K4 | 4.72×103 | 7.68×10 |
②某温度下,H2O(g)?H2(g)+
| 1 |
| 2 |
(2)热化学循环制氢
已知:Br2(g)+CaO(s)→CaBr2(s)+
| 1 |
| 2 |
3FeBr2(s)+4H2O(g)→Fe3O4(s)+6HBr(g)+H2(g)△H=384kJ/mol
CaBr2(s)+H2O(g)→CaO(s)+2HBr(g)△H=212kJ/mol
Fe3O4(s)+8HBr(g)→Br2(g)+3FeBr2(s)+4H2O(g)△H=-274kJ/mol
则H2O(g)?H2(g)+
| 1 |
| 2 |
(3)光电化学分解制氢,其原理如图1.

钛酸锶光电极的电极反应为4OH一+4hv-O2+2H2O,则铂电极的电极反应为
(4)生物质制氢,若将生物质气化炉中出来的气体[主要有CH4、CO2、H2O(g)、CO及H2]在1.0 1×105Pa下,进入转换炉,改变温度条件,各成分的体积组成关系如图2所示.下列有关图象的解读正确的是
A.利用CH4与H2O(g)及CO2转化为合成气CO和H2理论上是可行的
B.CH4(g)+CO2(g)→2CO(g)+2H2(g)和CH4(g)+H2O(g)→CO(g)+3H2(g),都是放热反应
C.CH4与CO2及H2O(g)转化为合成气CO和H2适宜温度约900℃
D.图象中曲线的交点处表示反应达到平衡
(5)LiBH4由于具有非常高的储氢能力,分解时生成氢化锂和两种单质,试写出反应的化学方程式
(11分)
(1)已知H2(g)+Br2(1)2HBr(g) △H=-72kJ/mol,蒸发1mol Br2(1)需要吸收的能量为30kJ,其它相关数据如下表:
|
|
H2(g) |
Br2(g) |
HBr(g) |
|
键能/kJ·mol-1 |
436 |
a |
369 |
①Br2(1)=Br2(g) △H1,则△H1=_____________;
②写出H2(g)与Br2(g)反应生成HBr(g)的热化学方程式:_____________________________
③试计算a=_________________。
(2)磷在氧气中燃烧,可能生成两种固态氧化物。3.1g的单质磷(P)在一定量氧气中燃烧生成P2O3、P2O5各0.025mol,反应物完全耗尽,并放出X kJ热量。
①已知1mol磷完全燃烧生成稳定氧化物放出的热量为Y kJ,则1molP与O2反应生成固态P2O3的反应热△H=________________________________。
②写出1mol P与O2反应生成固态P2O3的热化学方程式:
___________________________________________________________________
查看习题详情和答案>>
氢能以其洁净、高效、高热值、环境友好等特点成为最有前途的新能源,制氢和储氢方法很多。
(1)直接热分解法制氢
(1)直接热分解法制氢
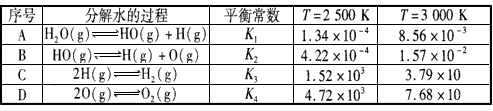
①属于吸热反应的是___(选填:A、B、C、D)。
②某温度下,H2O(g)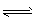 H2(g)+1/2O2(g),平衡常数K=___(用含K1、K2、K3、K4的式子表示)。
H2(g)+1/2O2(g),平衡常数K=___(用含K1、K2、K3、K4的式子表示)。
(2)热化学循环制氢
已知:
Br2(g)+CaO(s)=CaBr2(s) +1/2O2(g) △H= -73 kJ/mol
3FeBr2(s)+4H2O(g)=Fe3O4(s)+6HBr(g)+H2(g) △H=+384 kJ/mol
CaBr2(s)+H2O(g)=CaO(s)+2HBr(g) △H=+212 kJ/mol
Fe3O4(s) +8HBr(g)=Br2(g)+3FeBr2(s)+4H2O(g) △H= -274 kJ/mol
则:H2O(g)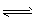 H2 (g) +1/2O2 ( g) △H=-___kJ/mol。
H2 (g) +1/2O2 ( g) △H=-___kJ/mol。
(3)光电化学分解制氢 光电化学分解制氢原理如图所示。钛酸锶光电极的电极反应为
4OH-+ 4hv-4e-→O2↑+2H2O,则铂电极的电极反应为___。
②某温度下,H2O(g)
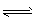 H2(g)+1/2O2(g),平衡常数K=___(用含K1、K2、K3、K4的式子表示)。
H2(g)+1/2O2(g),平衡常数K=___(用含K1、K2、K3、K4的式子表示)。(2)热化学循环制氢
已知:
Br2(g)+CaO(s)=CaBr2(s) +1/2O2(g) △H= -73 kJ/mol
3FeBr2(s)+4H2O(g)=Fe3O4(s)+6HBr(g)+H2(g) △H=+384 kJ/mol
CaBr2(s)+H2O(g)=CaO(s)+2HBr(g) △H=+212 kJ/mol
Fe3O4(s) +8HBr(g)=Br2(g)+3FeBr2(s)+4H2O(g) △H= -274 kJ/mol
则:H2O(g)
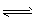 H2 (g) +1/2O2 ( g) △H=-___kJ/mol。
H2 (g) +1/2O2 ( g) △H=-___kJ/mol。 (3)光电化学分解制氢 光电化学分解制氢原理如图所示。钛酸锶光电极的电极反应为
4OH-+ 4hv-4e-→O2↑+2H2O,则铂电极的电极反应为___。
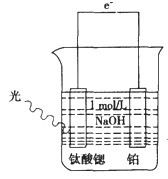
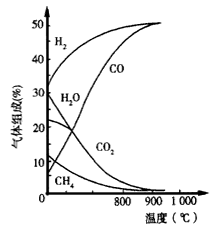
(4)生物质制氢
若将生物质气化炉中出来的气体[主要有CH4、CO2、H2O(g)、CO及 H2]在1. 01×105 Pa下,通入转换炉,改变温度条件,各成分的体积组成关系如图所示。下列有关图象的解读正确的是__。
A.利用CH4与H2O(g)及CO2转化为合成气CO和H2,理论上是可行的
B.CH4(g)+CO2(g)→2CO(g)+2H2(g)和CH4(g) +H2O(g)→ CO(g)+3H2(g),都是放热反应
C.CH4与CO2及H2O(g)转化为合成气CO和H2的适宜温度约为 900℃
D.图象中曲线的交点处表示反应达到平衡
若将生物质气化炉中出来的气体[主要有CH4、CO2、H2O(g)、CO及 H2]在1. 01×105 Pa下,通入转换炉,改变温度条件,各成分的体积组成关系如图所示。下列有关图象的解读正确的是__。
A.利用CH4与H2O(g)及CO2转化为合成气CO和H2,理论上是可行的
B.CH4(g)+CO2(g)→2CO(g)+2H2(g)和CH4(g) +H2O(g)→ CO(g)+3H2(g),都是放热反应
C.CH4与CO2及H2O(g)转化为合成气CO和H2的适宜温度约为 900℃
D.图象中曲线的交点处表示反应达到平衡
(5) LiBH4由于具有非常高的储氢能力,分解时生成氢化锂和两种单质,试写出反应的化学方程式______。
查看习题详情和答案>>
(1)已知H2(g)+Br2(l)==2HBr(g) △H=-72kJ/mol,蒸发1mol Br2(1)需要吸收的能量为30kJ,其它相关数据如下表

①Br2(l)=Br2(g) △H1,则△H1=_____________;
②写出H2(g)与Br2(g)反应生成HBr(g)的热化学方程式:________________;
③试计算a=_________________。
(2)磷在氧气中燃烧,可能生成两种固态氧化物。3.1g的单质磷(P)在一定量氧气中燃烧生成P2O3、P2O5各0.025mol,反应物完全耗尽,并放出X kJ热量。
①已知1mol磷完全燃烧生成稳定氧化物放出的热量为Y kJ,则1molP与O2反应生成固态P2O3的反应热△H=_____________。
②写出1mol P与O2反应生成固态P2O3的热化学方程式 ________________________。
查看习题详情和答案>>
②写出H2(g)与Br2(g)反应生成HBr(g)的热化学方程式:________________;
③试计算a=_________________。
(2)磷在氧气中燃烧,可能生成两种固态氧化物。3.1g的单质磷(P)在一定量氧气中燃烧生成P2O3、P2O5各0.025mol,反应物完全耗尽,并放出X kJ热量。
①已知1mol磷完全燃烧生成稳定氧化物放出的热量为Y kJ,则1molP与O2反应生成固态P2O3的反应热△H=_____________。
②写出1mol P与O2反应生成固态P2O3的热化学方程式 ________________________。
(11分)
(1)已知H2(g)+Br2(1) 2HBr(g) △H=-72kJ/mol,蒸发1mol Br2(1)需要吸收的能量为30kJ,其它相关数据如下表:
2HBr(g) △H=-72kJ/mol,蒸发1mol Br2(1)需要吸收的能量为30kJ,其它相关数据如下表:
| | H2(g) | Br2(g) | HBr(g) |
| 键能/kJ·mol-1 | 436 | a | 369 |
②写出H2(g)与Br2(g)反应生成HBr(g)的热化学方程式:_____________________________
③试计算a=_________________。
(2)磷在氧气中燃烧,可能生成两种固态氧化物。3.1g的单质磷(P)在一定量氧气中燃烧生成P2O3、P2O5各0.025mol,反应物完全耗尽,并放出X kJ热量。
①已知1mo
 l磷完全燃烧生成稳定氧化物放出的热量为Y kJ,则1molP与O2反应生成固态P2O3的反应热△H=________________________________。
l磷完全燃烧生成稳定氧化物放出的热量为Y kJ,则1molP与O2反应生成固态P2O3的反应热△H=________________________________。②写出1mol P与O2反应生成固态P2O3的热化学方程式:
___________________________________________________________________ 查看习题详情和答案>>