摘要:5.已知:HCN反应的ΔH=-12.1 kJ/mol,HCl(aq)与NaOH反应的ΔH=-55.6 kJ/mol.则HCN在水溶液电离的ΔH等于( ) A.-67.7 kJ/mol B.-43.5 kJ/mol C.+43.5 kJ/mol D.+67.7 kJ/mol 解析:根据盖斯定律.将HCN与NaOH的反应设计为以下两步: 则ΔH1=ΔH2+ΔH3=-12.1 kJ/mol=ΔH2+ ΔH2=+43.5 kJ/mol. 答案:C
网址:http://m.1010jiajiao.com/timu3_id_84915[举报]
(2011?江西二模)芳香族化合物A有如图的转化关系:

已知D能与NaOH溶液反应,E转化为F时,产物只有一种结构,且能使溴的四氯化碳溶液褪色.请回答下列问题:
(1)B的分子式是
(2)A、F的结构简式 A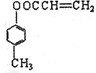
 F
F

(3)写出B→C、E→F的化学反应方程式,并注明反应类型B→C:
 E→F:
E→F: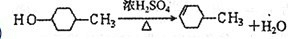
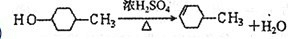
(4)符合下列3个条件的A的同分异构体有多种①苯环含有对二取代结构 ②遇FeCl3溶液不变色 ③能发生银镜反应
请写出其中任意一种的结构简式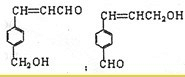
 .
.
查看习题详情和答案>>

已知D能与NaOH溶液反应,E转化为F时,产物只有一种结构,且能使溴的四氯化碳溶液褪色.请回答下列问题:
(1)B的分子式是
C3H4O2
C3H4O2
(2)A、F的结构简式 A




(3)写出B→C、E→F的化学反应方程式,并注明反应类型B→C:


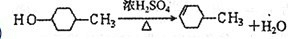
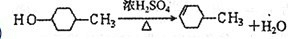
(4)符合下列3个条件的A的同分异构体有多种①苯环含有对二取代结构 ②遇FeCl3溶液不变色 ③能发生银镜反应
请写出其中任意一种的结构简式


芳香族化合物A有如下图的转化关系:
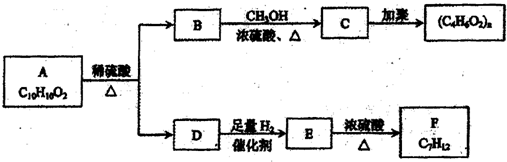
已知D能与NaOH溶液反应,E转化为F时,产物只有一种结构,且能使溴的四氯化碳溶液褪色.请回答下列问题:
(1)D中官能团的名称为
(2)B的分子式是
(3)A、F的结构简式:A
 F
F
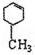
(4)写出B→C、E→F的化学反应方程式,并注明反应类型
B→C:
 (
(
(5)符合下列3个条件的A的同分异构体有多种
①苯环含有的二取代结构处于对位
②遇FeCl2溶液不变色
③能发生银镜的
请写出其中两种的结构简式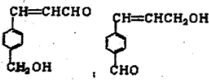
 .
.
查看习题详情和答案>>

已知D能与NaOH溶液反应,E转化为F时,产物只有一种结构,且能使溴的四氯化碳溶液褪色.请回答下列问题:
(1)D中官能团的名称为
(酚)羟基
(酚)羟基
(2)B的分子式是
C3H4O2
C3H4O2
(3)A、F的结构简式:A


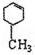
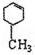
(4)写出B→C、E→F的化学反应方程式,并注明反应类型
B→C:
CH2=CHCOOH+CH3OH
CH2=CHCOOCH3+H2O
| 浓硫酸 |
| △ |
CH2=CHCOOH+CH3OH
CH2=CHCOOCH3+H2O
(| 浓硫酸 |
| △ |
取代
取代
)E→F:

消去
消去
)(5)符合下列3个条件的A的同分异构体有多种
①苯环含有的二取代结构处于对位
②遇FeCl2溶液不变色
③能发生银镜的
请写出其中两种的结构简式


已知稀硝酸与铜反应时,NO3-一般被还原为NO;浓硝酸与铜反应时,NO3-一般被还原为NO2.现将25.6gCu投入到50mL 12mol/L的浓硝酸中,充分反应后,收集到4.48L(标况)NO和NO2的混合气体.
(1)被还原的硝酸的物质的量为:
(2)25.6gCu与50mL 12mol/L的硝酸反应后,剩余物为:
(3)容积为4.48L的干燥烧瓶充满上述反应中收集的NO和NO2的混合气体(标况)后倒置于水中,须再通入
(4)如果往反应后的体系内再加入200mL4mol/L的稀硫酸,是否有气体逸出?若有,计算生成气体在标况下的体积(要求有简单过程,结果保留三位有效数字).
查看习题详情和答案>>
(1)被还原的硝酸的物质的量为:
0.2mol
0.2mol
.(2)25.6gCu与50mL 12mol/L的硝酸反应后,剩余物为:
Cu
Cu
,其物质的量为:0.2mol
0.2mol
.(3)容积为4.48L的干燥烧瓶充满上述反应中收集的NO和NO2的混合气体(标况)后倒置于水中,须再通入
2.24
2.24
L(标况)O2才能使溶液充满烧瓶.(4)如果往反应后的体系内再加入200mL4mol/L的稀硫酸,是否有气体逸出?若有,计算生成气体在标况下的体积(要求有简单过程,结果保留三位有效数字).
已知稀硝酸与铜反应时,NO3-一般被还原为NO;浓硝酸与铜反应时,NO3-一般被还原为NO2.现将25.6gCu投入到50mL 12mol/L的浓硝酸中,充分反应后,收集到4.48L(标况)NO和NO2的混合气体.
(1)被还原的硝酸的物质的量为:
(2)25.6gCu与50mL 12mol/L的硝酸反应后,剩余物为:
(3)容积为4.48L的干燥烧瓶充满上述反应中收集的NO和NO2的混合气体(标况)后倒置于水中,须再通入
查看习题详情和答案>>
(1)被还原的硝酸的物质的量为:
0.2mol
0.2mol
.(2)25.6gCu与50mL 12mol/L的硝酸反应后,剩余物为:
Cu
Cu
,其物质的量为:0.2mol
0.2mol
.(3)容积为4.48L的干燥烧瓶充满上述反应中收集的NO和NO2的混合气体(标况)后倒置于水中,须再通入
2.24
2.24
L(标况)O2才能使溶液充满烧瓶.(2011?东城区二模)(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O.甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如下(所取溶液体积均为10mL):
其他条件不变时:探究浓度对化学反应速率的影响,应选择
探究温度对化学反应速率的影响,应选择
(2)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8mol电子.该反应的离子方程式是
甲同学设计如下实验流程探究Na2S2O3的化学性质.
(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和
(Ⅱ)生成白色沉淀B的离子方程式是
(Ⅲ)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是
查看习题详情和答案>>
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol?L-1 | c(H2SO4)/mol?L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
①②
①②
(填实验编号);探究温度对化学反应速率的影响,应选择
①④
①④
(填实验编号).(2)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8mol电子.该反应的离子方程式是
S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+
S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+
.甲同学设计如下实验流程探究Na2S2O3的化学性质.

(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和
还原
还原
性.(Ⅱ)生成白色沉淀B的离子方程式是
SO42-+Ba2+=BaSO4↓
SO42-+Ba2+=BaSO4↓
.(Ⅲ)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是
乙
乙
(填“甲”或“乙”),理由是可以排除BaS2O3的干扰
可以排除BaS2O3的干扰
.