2.采用对比的方法,注意燃烧热和中和热的联系与区别。
|
|
研究条件 |
标准 |
能量变化 |
单位 |
注意事项 |
|
燃烧 |
101kPa |
1mol |
放热(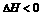 ) ) |
kJ/mol |
可燃物要完全燃烧,生成稳定的氧化物 |
|
中和热 |
稀溶液 |
生成1mol |
放热(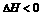 ) ) |
kJ/mol |
强酸与强大事碱在稀溶液中反应生成1mol 水,都放出57.3kJ热 |
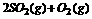 ⇌
⇌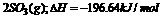 当放出314.3kI热量时,S02的转化率最接近于 ( )
当放出314.3kI热量时,S02的转化率最接近于 ( )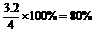
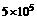 kJ,丁烷的燃烧热为 ,丁烷燃烧的热化学方程式为
。
kJ,丁烷的燃烧热为 ,丁烷燃烧的热化学方程式为
。 
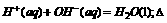 H=-57.3 kJ/mol,已知分别与l L0.1 mol/L的NaOH溶液恰好反应的下列物质:①乙酸溶液;②浓H2SO4;③稀硝酸,恰好反应后放出的热量分别为Q1 、Q2 、Q3 (单位:kJ),则Q1 、Q2 、Q3的关系正确的是 ( )
H=-57.3 kJ/mol,已知分别与l L0.1 mol/L的NaOH溶液恰好反应的下列物质:①乙酸溶液;②浓H2SO4;③稀硝酸,恰好反应后放出的热量分别为Q1 、Q2 、Q3 (单位:kJ),则Q1 、Q2 、Q3的关系正确的是 ( )
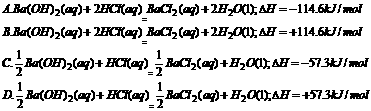
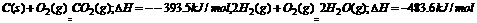 。现有0.2mol的炭粉和氢气组成的悬浮气,因混合物在氧气中完全燃烧,共放出63.53 kJ热量,则混合物中C与H2的物质的量之比为 ( )
。现有0.2mol的炭粉和氢气组成的悬浮气,因混合物在氧气中完全燃烧,共放出63.53 kJ热量,则混合物中C与H2的物质的量之比为 ( )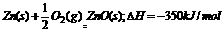 AH=-350kJ/mol,则lgZn在氧气中燃烧放出的热量约为 ( )
AH=-350kJ/mol,则lgZn在氧气中燃烧放出的热量约为 ( )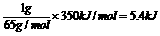
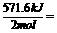 285.8 kJ/mol。中和热以生成L molH2O 为标准,而1.00 L 1.00mol/LH2SO4
溶液与2.00 L 1.00 mol/l NaOH溶液反应生成
2.molH20,故该反应的中和热为114.61d=57.3 kJ/mol。书写表示燃烧热与中和热的热化学方程式时,必须体现燃烧热与中和热的研究标准。
285.8 kJ/mol。中和热以生成L molH2O 为标准,而1.00 L 1.00mol/LH2SO4
溶液与2.00 L 1.00 mol/l NaOH溶液反应生成
2.molH20,故该反应的中和热为114.61d=57.3 kJ/mol。书写表示燃烧热与中和热的热化学方程式时,必须体现燃烧热与中和热的研究标准。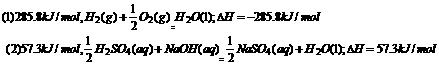
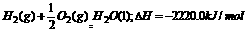 ,实验测得H2和C3H8的混合气体共5mol,完全燃烧时放热3 847kJ,则混合气体中H2和C3H8的体积比是 ;二者放出的热量之比约为
.
,实验测得H2和C3H8的混合气体共5mol,完全燃烧时放热3 847kJ,则混合气体中H2和C3H8的体积比是 ;二者放出的热量之比约为
.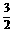 ,其体积比也大于
,其体积比也大于