键能是气态基态原子形成1mol化学键释放的最低能量。例如,形成1molH-H键释放的最低能量为436.0kJ、断开1molCl-Cl键吸收242.7KJ的能量,这些就是相应化学键的键能,通常取正值。故由上述知:△H约等于反应物的总键能与生成物的总键能之差。如下表
例3:(2010重庆12)已知 (g)+
(g)+ (l)=2
(l)=2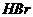 (g);△H=-72KJ/
(g);△H=-72KJ/ ,蒸发1
,蒸发1
 (l)需要吸收的能量为30KJ,其它相关数据如下表:
(l)需要吸收的能量为30KJ,其它相关数据如下表:
|
|
 (g) (g) |
 (g) (g) |
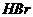 (g) (g) |
1 分子中的化学键断裂时需要吸收的能量/ KJ 分子中的化学键断裂时需要吸收的能量/ KJ |
436 |
a |
369 |
则表中a为( )
A 404 B 260 C 230 D200
解 析:
由已知得:Br2(l)=Br2(g) H=+30KJ/mol,则H2(g) + Br2(g) = 2HBr(g);H= -102KJ/mol。据△H约等于反应物的总键能与生成物的总键能之差知:436+a-2×369=-102;a=―200KJ,D项正确。


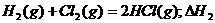

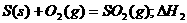
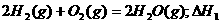

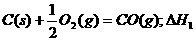


 /⊿S
/⊿S =-8568
=-8568 由于r(CO32-)>r(O2-),
由于r(CO32-)>r(O2-), >0
>0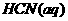 与
与 反应的⊿H=-12.1KJ/mol;HCl(aq)与
反应的⊿H=-12.1KJ/mol;HCl(aq)与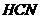 在水溶液中电离⊿H等于( )
在水溶液中电离⊿H等于( )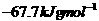 B.
B.
 D.
D. 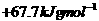 C
C ;⊿
;⊿
 ;⊿
;⊿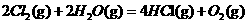 ;⊿
;⊿
 2NH3(g)
2NH3(g)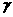 1=-1
1=-1  =
=  =
=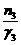 (单位:mol)
(单位:mol)  △H=-38.6kJ·mol-1
△H=-38.6kJ·mol-1
 3
3