网址:http://m.1010jiajiao.com/timu3_id_82543[举报]
 (2010?南通一模)CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.
(2010?南通一模)CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.(1)下列措施中,有利于降低大气中的CO2、SO2、NOx浓度的有
a.减少化石燃料的使用,开发新能源
b.使用无氟冰箱,减少氟里昂排放
c.多步行或乘公交车,少用专车或私家车
d.将工业废气用碱液吸收后再排放
(2)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应.该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为
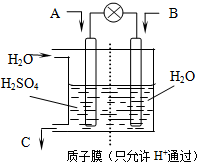
(3)有学者设想以如图所示装置用电化学原理将CO2、SO2转化为重要化工原料.
①若A为CO2,B为H2,C为CH3OH,则正极电极反应式为
②若A为SO2,B为O2,C为H2SO4.科研人员希望每分钟从C处获得100mL10mol/LH2SO4,则A处通入烟气(SO2的体积分数为1%)的速率为
CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径。
⑴下列措施中,有利于降低大气中的CO2、SO2、NOx浓度的有___ ___(填字母)。
a.减少化石燃料的使用,开发新能源
b.使用无氟冰箱,减少氟里昂排放
c.多步行或乘公交车,少用专车或私家车
d.将工业废气用碱液吸收后再排放
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 (只要求写一种)。
⑶有学者设想以下图所示装置用电化学原理将CO2、SO2转化为重要化工原料。
①若A为CO2,B为H2,C为CH3OH,则正极电极反应式为 。
②若A为SO2,B为O2,C为H2SO4。科研人员希望每分钟从C处获得100mL10mol/LH2SO4,则A处通入烟气(SO2的体积分数为1%)的速率为 L/min(标准状况)。
查看习题详情和答案>>
(8分)CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径。
⑴下列措施中,有利于降低大气中的CO2、SO2、NOx浓度的有______(填字母)。
a.减少化石燃料的使用,开发新能源
b.使用无氟冰箱,减少氟里昂排放
c.多步行或乘公交车,少用专车或私家车
d.将工业废气用碱液吸收后再排放
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 (只要求写一种)。
⑶有学者设想以右图所示装置用电化学原理将CO2、SO2转化为重要化工原料。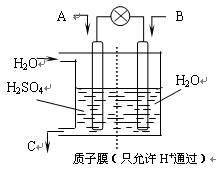
①若A为CO2,B为H2,C为CH3OH,则正极电极反应式为 。
②若A为SO2,B为O2,C为H2SO4。科研人员希望每分钟从C处获得100mL10mol/LH2SO4,则A处通入烟气(SO2的体积分数为1%)的速率为 L/min(标准状况)。
CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径。
⑴下列措施中,有利于降低大气中的CO2、SO2、NOx浓度的有___ ___(填字母)。
a.减少化石燃料的使用,开发新能源
b.使用无氟冰箱,减少氟里昂排放
c.多步行或乘公交车,少用专车或私家车
d.将工业废气用碱液吸收后再排放
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 (只要求写一种)。
⑶有学者设想以下图所示装置用电化学原理将CO2、SO2转化为重要化工原料。
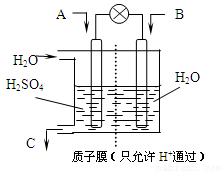
①若A为CO2,B为H2,C为CH3OH,则正极电极反应式为 。
②若A为SO2,B为O2,C为H2SO4。科研人员希望每分钟从C处获得100mL10mol/LH2SO4,则A处通入烟气(SO2的体积分数为1%)的速率为 L/min(标准状况)。
查看习题详情和答案>>
CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径。
⑴下列措施中,有利于降低大气中的CO2、SO2、NOx浓度的有______(填字母)。
a.减少化石燃料的使用,开发新能源
b.使用无氟冰箱,减少氟里昂排放
c.多步行或乘公交车,少用专车或私家车
d.将工业废气用碱液吸收后再排放
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 (只要求写一种)。
⑶有学者设想以右图所示装置用电化学原理将CO2、SO2转化为重要化工原料。
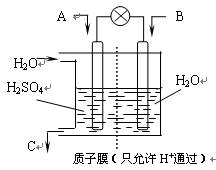
①若A为CO2,B为H2,C为CH3OH,则正极电极反应式为 。
②若A为SO2,B为O2,C为H2SO4。科研人员希望每分钟从C处获得100mL10mol/LH2SO4,则A处通入烟气(SO2的体积分数为1%)的速率为 L/min(标准状况)。
查看习题详情和答案>>