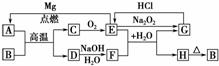
11. 某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
实验步骤 |
实验现象 |
|
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
|
反应结束后分离出溶液备用。 |
|
|
红色固体用蒸馏水洗涤后,置于潮湿空气中。 |
一段时间后固体由红色变为绿色[设其主要成分为Cu2(OH)2CO3]。 |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应__________________________________________________________________;
化合反应_________________________________________________________________。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可以观察到的现象是__________________________________________________。
解释此现象的离子方程式是____________________________________________________。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰。
①用铝与软锰矿炼锰的原理是(用化学方程式来表示)
________________________________________________________________________。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是__________________________________________。
解析:(1)由CuCl2溶液中Cu2+的水解使溶液呈酸性,所以会有2Al+6H+===2Al3++3H2↑,也有2Al+3Cu2+===2Al3++3Cu;单质铜在潮湿空气中由红色变为绿色,化学方程式可写出2Cu+O2+H2O+CO2===Cu2(OH)2CO3。
(2)用石墨作电极,电解AlCl3溶液,电解的方程式为:
2AlCl3+6H2O2Al(OH)3+3H2↑+3Cl2↑
持续电解,电解水,阴极:2H2O+2e-―→H2↑+2OH-从而使阴极区OH-浓度增大,所以会看到有白色沉淀生成,后沉淀逐渐溶解至消失。
(3)①类似于铝热反应
②根据题意可写出离子方程式:MnO2+H2O2+2H+===Mn2++O2↑+2H2O
答案:(1)2Al+6H+===2Al3++3H2↑ 或2Al+3Cu2+===2Al3++3Cu 2Cu+O2+H2O+CO2===Cu2(OH)2CO3 (2)白色沉淀生成,后沉淀逐渐溶解至消失 Al3++3OH-===Al(OH)3↓, Al(OH)3+OH-===[Al(OH)4]- (3)①3MnO2+4Al高温,3Mn+2Al2O3
②MnO2+H2O2+2H+===Mn2++O2↑+2H2O
8.(2008·广东,22)铜在自然界存在于多种矿石中,如:
|
矿石名称 |
黄铜矿 |
斑铜矿 |
辉铜矿 |
孔雀石 |
|
主要成分 |
CuFeS2 |
Cu5FeS4 |
Cu2S |
CuCO3·Cu(OH)2 |
请回答下列问题:
(1)上表所列铜化合物中,铜的质量百分含量最高的是________。
(2)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S6Cu+SO2↑,反应的氧化剂是__________。
(3)SO2尾气直接排放到大气中造成环境污染的后果是__________________;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称____________。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请简述粗铜电解得到精铜的原理:______________________________________________。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是__________(填字母)。
|
选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
|
A |
铜绿的主要成分是碱式碳酸铜 |
可用稀盐酸除铜器表面的铜绿 |
Ⅰ对;Ⅱ对;有 |
|
B |
铜表面易形成致密的氧化膜 |
铜容器可以盛放浓硫酸 |
Ⅰ对;Ⅱ对;有 |
|
C |
铁比铜活泼 |
铆在铜板上的铁钉在潮湿空气中不易生锈 |
Ⅰ对;Ⅱ对;有 |
|
D |
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 |
硫酸铜溶液可用作游泳池的消毒剂 |
Ⅰ错;Ⅱ对;无 |
解析:(1)根据矿石的主要成分分析可知:每1 mol Cu中含有的其他元素的质量Cu2S中最小,因此Cu2S中铜的质量分数最高。
(2)根据反应方程式: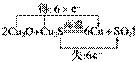 ,可知Cu2O和Cu2S都作氧化剂。
,可知Cu2O和Cu2S都作氧化剂。
(3)SO2排放到大气中会造成酸雨,处理该尾气可得到有价值的化学品:H2SO4或Na2SO4。
(4)粗铜的精炼中,应将粗铜与电源的正极相连作阳极,而将纯铜与电源的负极相连作阴极,用铜盐CuSO4、CuCl2等盐溶液作电解质溶液。
(5)铜绿的成分为Cu2(OH)2CO3,能与盐酸发生反应而除去,而Cu和盐酸不反应,A正确;铜在常温下和浓H2SO4不反应,因此B中前后无因果关系,B错误;在潮湿的空气中铁和铜形成原电池,铁作负极,铜作正极,铁易生锈,因此C也不正确;CuSO4·5H2O晶体转化为CuSO4白色粉末是化学变化,CuSO4为重金属盐,可以使蛋白质变性,因此可以作为消毒剂,因此D正确。
答案:(1)Cu2S (2)Cu2S和Cu2O (3)形成酸雨,会对植物和建筑物等造成严重危害 硫酸、硫酸钠 (4)以硫酸铜→硫酸溶液为电解液。电解时,粗铜(阳极)中的铜以及比铜活泼的金属失去电子进入溶液,不如铜活泼的金属沉入电解槽形成“阳极泥”;溶液中的Cu2+得到电子沉积在纯铜(阴极)上 (5)AD