16.下列三种化合物A、B、C中所含有的元素不多于三种,且分子内所含X、Y元素的质量分数及化合物的部分性质列于下表:
|
化合物 |
A |
B |
C |
|
w(X) |
0.077
9 |
0.237
6 |
0.75 |
|
w(Y) |
0.922
1 |
0.703 |
0 |
|
常压下T℃时的密度(g/cm3) |
1.594
7(20℃) |
2.254
5×10-3(0℃) |
0.668×10-3(20℃) |
|
沸点/℃ |
76.8 |
-23.7 |
-161.49 |
|
熔点/℃ |
-22.95 |
-97 |
-182.48 |
原子质量均大于10,且Y的相对原子质量比X的相对原子质量的两倍还要大。根据上述有关信息回答下列问题:
(1)化合物B的相对分子质量为________。
(2)确定化合物C的推理过程为:________。
(3)A与B的化学式为A________,B________。
解析:(1)分析表格数据可以发现B、C常温下均为气态,已知B标准状况下的密度,根据M=22.4 L/mol×2.254 5×10-3 g/cm3×103=50.5 g/mol,即得其相对分子质量;B中肯定含有另外一种元素,该元素在B中占有总质量为50.5×(1-0.703-0.237 6)=3,原子量小于3的只有氢,说明B中含有H。
(2)C中Y含量为0,X含量为75%,即C中一定含有H,且含量为25%。设C的分子式为XHn,根据=25%,Mr(X)=3n,讨论n=1、2、3、4,可得只有n=4合理。X相对原子质量为12,则X为碳,C的分子式为CH4。
(3)根据B中H总质量为3,说明B中含有3个氢原子,B的分子式设为CaH3Yb,则12a+3+bMr(Y)=50.5,由于B中X含量为0.237 6,故a=1,则bMr(Y)=35.5,只有b=1合理,Y的相对原子质量为35.5,即氯元素。根据A的含量只有X、Y两种元素可以确定A为CCl4。
答案:(1)50.5 (2)见解析(2) (3)CCl4 CH3Cl
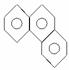 ,其一氯代物的数目为( )
,其一氯代物的数目为( ) 故一氯取代物有5种。
故一氯取代物有5种。 的单体是
的单体是
 )是由乙烯加聚生成的纯净物
)是由乙烯加聚生成的纯净物 关于生物体内氨基酸的叙述错误的是( )
关于生物体内氨基酸的叙述错误的是( )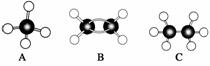

 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示,则烷烃(除甲烷外)中存在的关系有:(用以上符号回答)
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示,则烷烃(除甲烷外)中存在的关系有:(用以上符号回答)

