9. 有X、Y、Z、W四种含氧酸,其成酸元素均为元素周期表中的短周期元素。将分别含有一定质量的X、Y、Z、W的水溶液进行光照或微热(有关的反应均进行完全),测得的数据如下表:
|
含氧酸 |
X |
Y |
Z |
W |
|
含氧酸的质量/g |
25.2 |
a |
3.1 |
10.5 |
|
生成物U的质量/g |
3.2 |
/ |
/ |
3.2 |
|
生成物V的质量/g |
3.6 |
0.9 |
0.9 |
/ |
|
不同生成物Q的质量/g |
18.4 |
3.2 |
b |
c |
据此判断下列叙述正确的是( )
A.表中的数据a=5.1 g
B.含氧酸Y为硫酸
C.四种含氧酸的成酸元素的化合价分别为+4、+5
D.四种含氧酸中有一种是强电解质、三种是弱电解质
解析:在常见含氧酸中,光照或加热分解产物有三种的有硝酸,据此可以确定X为HNO3,则U为O2,V为H2O,Q为NO2;由质量守恒可知a=0.9+3.2=4.1,b=3.1-0.9=2.2 g,c=10.5-3.2=7.3,并由此可以确定Y为H2SO3,Z为H2CO3,W为HClO,所以选项D正确,A、B、C不正确;选D。
答案:D
 2NH3
2NH3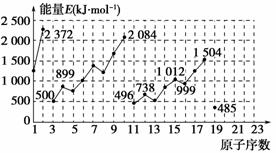 下图为不同元素的气态原子失去最外层一个电子所需要的能量。试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
下图为不同元素的气态原子失去最外层一个电子所需要的能量。试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
 (3)j XeO3+3NaBrO33NaBrO4+Xe
(3)j XeO3+3NaBrO33NaBrO4+Xe
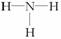
 D.热稳定性:H2S>HF
D.热稳定性:H2S>HF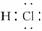 ,C项错误;由于硫的非金属性比氟弱,其氢化物H2S的稳定性比HF弱。
,C项错误;由于硫的非金属性比氟弱,其氢化物H2S的稳定性比HF弱。