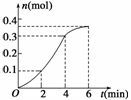
19.如下图Ⅰ,在恒压密闭容器M中加入2
mol A和2 mol B,起始时容器容积为V
L,发生如下反应并达到化学平衡状态:2A(?)+B(?) xC(g);ΔH<0
xC(g);ΔH<0
平衡时A、B、C的物质的量之比为1∶3∶4,C的物质的量为y mol。
(1)根据题中数据计算,x=________,y=________;
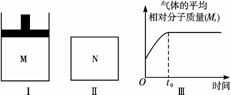
(2)如图Ⅱ,在容积为V L的恒容密闭容器N中发生上述反应(其他条件相同),测得反应过程中气体的平均相对分子质量随时间的变化如图Ⅲ(t0时达平衡),平衡时容器中C的物质的量为z mol。由于反应物A、B的状态未知,则z和y的大小也不确定,请在下表中填入A、B的状态与z、y的大小之间的关系(仿照情形①、可不填满):
|
可能的情形 |
A、B是否为气态 |
z与y的大小关系 |
M(B)与M(C)的大小关系(M表示摩尔质量) |
|
|
A |
B |
|||
|
① |
是 |
不是 |
z=y |
无法确定 |
|
② |
|
|
|
|
|
③ |
|
|
|
|
解析:(1)设平衡时生成C为nx mol,根据反应可得平衡时A为(2-2n)mol,B为(2-n)mol,nx=y。则有:(2-2n)∶(2-n)∶nx=1∶3∶4,解得n=0.8,x=2,y=1.6。
(2)当A、B均为气体时,该反应的正反应为气体体积减小的反应,恒压比恒容更有利于反应向右进行,故平衡时C的物质的量z<y,此时结合图像Ⅲ可知M(C)=M(A)+M(B),但因M(A)值不确定,所以无法确定M(B)与M(C)相对大小;当A不是气体,B为气体时,该反应正反应为气体体积增大的反应,Ⅰ中保持恒压,而Ⅱ保持恒容,所以反应Ⅰ中压强会小于Ⅱ中压强,所以Ⅰ中保持恒压比Ⅱ中保持恒容更有利于反应向右进行,故平衡时C的量z<y,此时只有B、C两种气体,由图像Ⅲ可知由B生成C,气体平均分子量增大,故M(B)<M(C);因为开始时气体的平均相对分子质量不为0,故不存在A、B均为非气体的情况。
答案:(1)2 1.6
(2)
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
是 |
是 |
z<y |
无法确定 |
|
|
不是 |
是 |
z<y |
M(B)<M(C) |
16. 某化学反应2A B+D在四种不同条件下进行。B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
某化学反应2A B+D在四种不同条件下进行。B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
|
实验序号 |
温度 |
0min |
10min |
20min |
30min |
40min |
50min |
60min |
|
1 |
820℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
820℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
800℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
800℃ |
1.0 |
0.20 |
0.20 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)在实验1中,反应在10至20 min时间内平均速率为________mol·(L·min)-1。
(2)在实验2中,A的初始浓度c2=______mol/L,反应经20 min就达到平衡,可推测实验2中还隐含的条件是____________________________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3____v1(填“>”“=”或“<”),且c3____1.0 mol/L(填“<”“=”或“>”)。
(4)比较实验4和实验1,可推测该反应是________反应(填“吸热”或“放热”),理由是________________________________________________________________________
________________________________________________________________________。
解析:(1)v(A)==0.013 mol·(L·min)-1
(2)对比实验1与实验2可知,反应温度相同,达平衡时的A的浓度相同,说明是同一平衡状态,即c2=1.0 mol/L,又因实际反应的速率快,达平衡所需时间短,说明反应中使用了催化剂。
(3)对比实验3与实验1可知,从10 min至20 min,实验1的A的浓度变化值为0.13 mol/L,而实验3的A的浓度变化值为0.17 mol/L,这说明了v3>v1。又知从0 min到10 min,A的浓度的变化值应大于0.17 mol/L,即c3>(0.92+0.17) mol/L=1.09 mol/L。
(4)对比实验4与实验1可知,两实验的起始浓度相同,反应温度不同,达平衡时实验4的A的浓度小,说明了实验④中A进行的程度大,即温度越低,A的转化率越大,说明正反应为放热反应。
答案:(1)0.013 (2)1.0 催化剂 (3)> > (4)放热 温度升高时,平衡向左移动
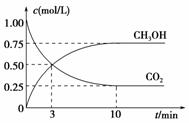
 CO2(g)+3H2(g) CH3OH(g)+H2O(g);
CO2(g)+3H2(g) CH3OH(g)+H2O(g); ①从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)。
①从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)。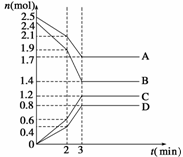
 6C+4D。
6C+4D。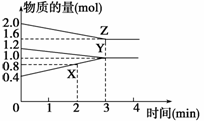
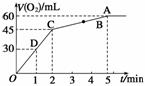
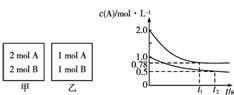 的变化如图所示。下列说法正确的是( )
的变化如图所示。下列说法正确的是( )