[设计与实施方案](1)取步骤③所得的溶液少许,于一支洁净试管中,滴加KSCN溶液,如溶液不显血红色,再向溶液中滴加少量氯水,溶液显血红色,证明原溶液中只含有Fe2+ (2)过量 防止未反应的铁与硫酸反应,生成亚铁离子干扰实验 (3)防止氧气参与反应 (4)铁和硫的反应是放热反应 (5) 除去过量的硫粉 3S+6OH-2S2-+SO+3H2O (6)③ 为了防止溶液中的氧气氧化亚铁离子 在滤渣中加入煮沸的稀H2SO4
20.某研究性学习小组计划研究当地酸雨的形成过程,于是取来雨水做水样进行测定,随时间的
推移,多次测定该样品的pH,得到如下数据:
|
时间(h) |
开始 |
8 |
16 |
24 |
32 |
40 |
48 |
|
pH |
5.0 |
4.8 |
4.5 |
4.3 |
4.2 |
4.0 |
4.0 |
(1) 雨水样品放置时pH变化的主要原因为______________(用化学方程式表示)。由此可以
得到酸雨的形成过程可能是________。如果将刚取样的上述雨水和自来水相混合,pH将
________(填“增大”、“减小”或“不变”),原因是___________________________
_____________________________________________________________,二氧化硫表现
________________性。
(2)下面是酸雨给人类造成的危害,其中不正确的是( )
A.腐蚀建筑物、雕塑等 B.污染水源 C.改良碱性土壤 D.损害庄稼
(3)你认为减少酸雨产生的途径可采取的措施是( )
①少用煤做燃料;②把工厂的烟囱造高;③燃料脱硫;④在已酸化的土壤中加石灰;
⑤开发新能源。
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
(4)为了减少煤燃烧时向大气排放的二氧化硫,不同的地方往往采取不同的“固硫”方法。
①火力发电厂常用氢氧化钙的悬浊液吸收煤燃烧时产生的二氧化硫气体,并用来制取石
膏(CaSO4·2H2O),则有关的化学反应方程式为:
________________________________________________________________________,
________________________________________________________________________。
② 硫酸工业常用浓氨水来吸收二氧化硫,则有关的化学方程式为
________________________ ______,____________________________。
③有些工业将生石灰和含硫煤混合作用,请写出燃烧时有关“固硫”反应的化学方程
式_______________________________________________________________________,
________________________________________________________________________。
④国际上最新采用“饱和亚硫酸钠溶液吸收二氧化硫法”,请写出有关反应的化学方
程式。
________________________________________________________________________。
分析:要答好此题首先要明确酸雨的成因,空气中的二氧化硫、三氧化硫及氮的氧化
物与水反应随雨水降落到地面,形成酸雨,酸雨的pH<5.6。酸雨的主要成分是亚硫酸,
亚硫酸中的硫元素为+4价,具有强的还原性,易被氧化剂氧化。
解析:酸雨的pH发生变化,其原因是亚硫酸被空气中的氧气氧化为硫酸,酸性增强,
当亚硫酸全部氧化为硫酸后,pH不再变化。自来水常用氯气消毒,其中的氯气、次氯
酸等能把亚硫酸氧化为硫酸,使pH减小。
酸雨的危害极大,会危害农作物、森林、草原、鱼类、建筑物、工业设备、电信电
缆等。
要减少酸雨的产生,首先要了解空气中二氧化硫的来源。大气中二氧化硫的来源主要
是化石燃料的燃烧以及含硫矿石的冶炼和硫酸、磷肥、造纸等生产过程产生的尾气。
因此少用煤做燃料以及对燃料进行脱硫处理,是减少酸雨的有效措施。开发新能源如
氢能、核能等可以从根本上杜绝二氧化硫的产生。至于把烟囱造高,显然不会改变二
氧化硫的排放量,对全球酸雨的危害不会减少。在已酸化的土壤中施石灰,是对因酸
雨造成的危害的被动治理措施,与从源头上控制二氧化硫的产生无关。
燃料脱硫(又叫“固硫”),利用了二氧化硫具有酸性氧化物的性质,故用碱性物质吸收,
从而生成盐。
答案:(1)2H2SO3+O2===2H2SO4 雨水溶解二氧化硫生成亚硫酸,亚硫酸又被空气中样的氧化剂氧化为硫酸,降落下来形成酸雨 减小 自来水中的氯气(或次氯酸)把亚硫
酸氧化成硫酸 还原 (2)C (3)C (4)①Ca(OH)2+SO2===CaSO3↓+H2O 2CaSO2
+O2===2CaSO4 CaSO4+2H2O===CaSO4·2H2O ②2NH3·H2O+SO2===(NH4)2SO3
+H2O
2(NH4)2SO3+O2===2(NH4)2SO4 ③S+O2SO2 CaO+SO2CaSO3
2CaSO3+O2===2CaSO4 ④Na2SO3+SO2+H2O===2NaHSO3
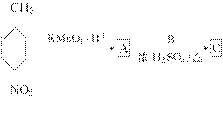
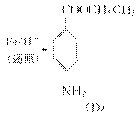
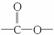 结构的基团
结构的基团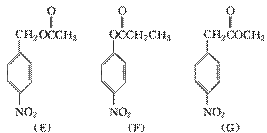
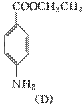 +C2H5OH
+C2H5OH 在KMnO4(H+)作用下-CH3被氧化成-COOH,由C转化为D时为还原,可知是-NO2转化为-NH2,说明A转化为C是发生酯化反应形成-COOCH2CH3结构,所以A为
在KMnO4(H+)作用下-CH3被氧化成-COOH,由C转化为D时为还原,可知是-NO2转化为-NH2,说明A转化为C是发生酯化反应形成-COOCH2CH3结构,所以A为  、B为CH3CH2OH、C为
、B为CH3CH2OH、C为 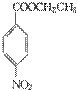 ;(2)
;(2) 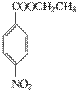 中对位对称,共有4种氢;(3)中据信息可知结构中对位有-NO2且含有
中对位对称,共有4种氢;(3)中据信息可知结构中对位有-NO2且含有 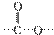 结构,说明是酯或羧酸,先考虑酯,先拿出
结构,说明是酯或羧酸,先考虑酯,先拿出  ,酸化后生成
,酸化后生成 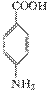 ,发生缩聚反应形成高分子纤维。
,发生缩聚反应形成高分子纤维。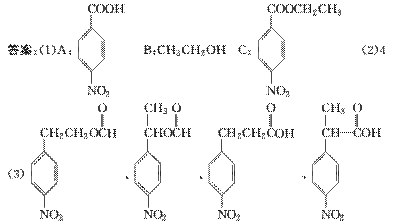
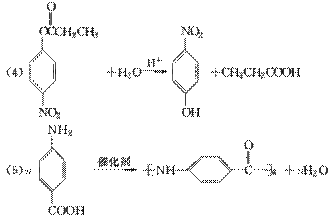
 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成: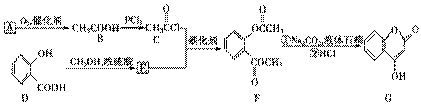
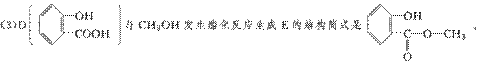 (4)F在强碱性条件下水解,生成二种钠盐和甲醇等。
(4)F在强碱性条件下水解,生成二种钠盐和甲醇等。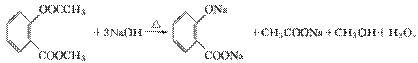 (5)G结构中含苯环、酯基、醇羟基以及碳碳双键,能与Br2发生加成反应或取代反应,与金属钠发生反应生成氢气,1 mol G中含有1 mol碳碳双键和1 mol苯环,可与4 mol H2加成;分子式C9H6O3。正确选项有a、b、d。
(5)G结构中含苯环、酯基、醇羟基以及碳碳双键,能与Br2发生加成反应或取代反应,与金属钠发生反应生成氢气,1 mol G中含有1 mol碳碳双键和1 mol苯环,可与4 mol H2加成;分子式C9H6O3。正确选项有a、b、d。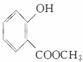
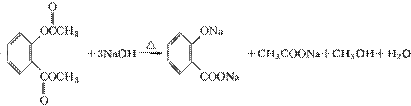 (5)a、b、d
(5)a、b、d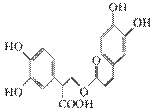 (2009·上海单科,9)迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如下图。下列叙述正确的是( )
(2009·上海单科,9)迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如下图。下列叙述正确的是( )
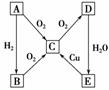
 2SO3 (3)能 H2S+H2SO4(浓)===S↓+SO2↑+2H2O
2SO3 (3)能 H2S+H2SO4(浓)===S↓+SO2↑+2H2O