10.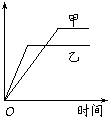 如图所示。该图象表示下表中的情形
如图所示。该图象表示下表中的情形
|
|
反应 |
纵坐标 |
甲 |
乙 |
|
A |
等质量钾、钠分别与水反应 |
H2质量 |
钠 |
钾 |
|
B |
相同质量氨,在同一容器中 2NH3  N2+3H2 N2+3H2 |
氨气的转化率 |
400℃ |
500℃ |
|
C |
体积比1∶3的N2,H2,在体积可变的恒压容器中, N2+3H2  2NH3 2NH3 |
氨气的浓度 |
活性高的催化剂 |
活性一般的催化剂 |
|
D |
2mo1SO2与lmo1O2,在相同温度下 2SO2+O2  2SO3 2SO3 |
SO3的物质的量 |
105Pa |
2×105Pa |
 过碳酸钠(Na2CO4)跟稀硫酸反应的化学方程式如下:
过碳酸钠(Na2CO4)跟稀硫酸反应的化学方程式如下:
 H++
SO42- 。
H++
SO42- 。