20.(1)根据下表所列的数据,可以得出HX、HY、HZ三种一元酸的酸性由强到弱的顺序是__________。
|
酸 |
HX |
HY |
HZ |
|
|
|
浓度(mol·L-1) |
0.1 |
0.5 |
0.9 |
1 |
1 |
|
电离度(α) |
0.3 |
0.15 |
0.1 |
0.3 |
10 |
(2)25℃时,测得浓度为0.1 mol·L-1的HA溶液的pH=3,则HA的电离常数Ka=__________。
(3)苯酚
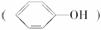 具有弱酸性,其电离常数介于H2CO3的Ka1和Ka2之间。则向苯酚钠
具有弱酸性,其电离常数介于H2CO3的Ka1和Ka2之间。则向苯酚钠 溶液中通入二氧化碳气体,所发生反应的化学方程式是__________。
溶液中通入二氧化碳气体,所发生反应的化学方程式是__________。
(4)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3HCO+H+的平衡常数K1=__________。(已知:10-5.60=2.5×10-6)
解析:(1)当HY和HZ的浓度相等时,α(HZ)>α(HY),则酸性HZ>HY;当HX和HY的电离度均为0.3时,c(HX)<c(HY),说明当c(HX)=c(HY)时,α(HX)<α(HY),即酸性HY>HX。
(2)由HAH++A- 知c(H+)=c(A-)=10-3mol·L-1,
则Ka==1×10-5mol·L-1。
(3)酸性:H2CO3>
 >HCO,则H2CO3能与
>HCO,则H2CO3能与 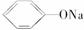 反应但HCO不与
反应但HCO不与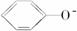 反应,不管CO2是少量还是过量,均只生成NaHCO3。
反应,不管CO2是少量还是过量,均只生成NaHCO3。
(4)根据平衡常数K1=,c(H+)=c(HCO)=2.5×10-6mol·L-1,c(H2CO3)=1.5×10-5mol·L-1,可求出K1。
答案:(1)HZ>HY>HX (2)1×10-5
(3)
 +CO2+H2O―→
+CO2+H2O―→ +NaHCO3 (4)4.2×10-7
+NaHCO3 (4)4.2×10-7
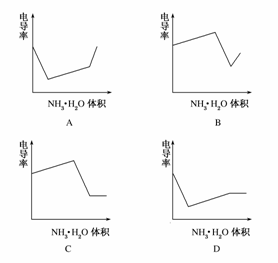
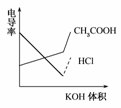 (2008·广东高考题)电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。如图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是 ( )
(2008·广东高考题)电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。如图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是 ( )