23.天然气;增大;天然气不完全燃烧,产生有毒的CO;丁烷遇冷凝结为液体,使管道流通不畅。
|
|
20.(2010重庆卷)已知H2(g)+Br2(l) 2HBr (g);△H=-72kJ·mol-1 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
|
|
H2(g) |
Br2(g) |
HCl(g) |
|
1mol分子中的化学键断裂时需要吸收的能量/KJ |
436 |
a |
369 |
则表中a为
A.404 B.260 C.230 D.200
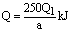 ⑵ag胆矾失水后溶于水中放出Q2kJ热量
CuSO4·5H2O-CuSO4
250g 160g
a g
⑵ag胆矾失水后溶于水中放出Q2kJ热量
CuSO4·5H2O-CuSO4
250g 160g
a g 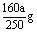 CuSO4(s)=CuSO4(ag);△H′
160g Q′
CuSO4(s)=CuSO4(ag);△H′
160g Q′
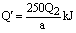 ⑶设CuSO4·5H2O分解为CuSO4和5H2O的热效应为△H。
根据⑴可知:①CuSO4·5H2O(s)= CuSO4(aq)+5H2O(l);
△H 1 =+250Q1 /a kJ·mol-1
根据⑵可知:②CuSO4(s)= CuSO4(ag);△H 2 =-250Q2/a kJ·mol-1
①-②得:
CuSO4·5H2O(s)=CuSO4(s)+5H2O(l);△H =△H 1-△H 2
∴△H =△H 1-△H 2=
⑶设CuSO4·5H2O分解为CuSO4和5H2O的热效应为△H。
根据⑴可知:①CuSO4·5H2O(s)= CuSO4(aq)+5H2O(l);
△H 1 =+250Q1 /a kJ·mol-1
根据⑵可知:②CuSO4(s)= CuSO4(ag);△H 2 =-250Q2/a kJ·mol-1
①-②得:
CuSO4·5H2O(s)=CuSO4(s)+5H2O(l);△H =△H 1-△H 2
∴△H =△H 1-△H 2=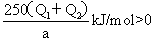 故此过程为吸热热反应。
答案:(1)250Q1/a
吸热(2)250Q2/a 放热(3)吸热 250(Q1+Q2)/a
故此过程为吸热热反应。
答案:(1)250Q1/a
吸热(2)250Q2/a 放热(3)吸热 250(Q1+Q2)/a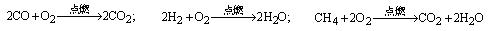 根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是_________。因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是_________进风口(填增大或减小),如不作改进可能产生的不良结果是_________________。管道煤气中含有的烃类,除甲烷外,还有少量乙烷、丁烷等,它们的某些性质见下表:
根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是_________。因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是_________进风口(填增大或减小),如不作改进可能产生的不良结果是_________________。管道煤气中含有的烃类,除甲烷外,还有少量乙烷、丁烷等,它们的某些性质见下表: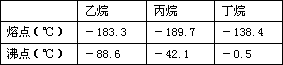
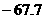 kJ·mol-1 B.-43.5 kJ·mol-1 C.+43.5
kJ·mol-1 D.+67.7
kJ·mol-1
kJ·mol-1 B.-43.5 kJ·mol-1 C.+43.5
kJ·mol-1 D.+67.7
kJ·mol-1 N2(g)+3H2(g) 2NH3(g) △H=-38.6kJ·mol-1
N2(g)+3H2(g) 2NH3(g) △H=-38.6kJ·mol-1