19.(12分)(2009·山东省济宁市高三第一学期质检)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA物质的量 浓度(mol/L) |
NaOH物质的 量浓度(mol/L) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
c1 |
0.2 |
pH=7 |
|
丙 |
0.2 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=9 |
请回答下列问题:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸__________________________。
(2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2________(填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是________。
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是________酸(填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol/L。写出该混合溶液中下列算式的精确结果(不能做近似计算,回答准确值,结果不一定要化简)。c(Na+)-c(A-)=________mol/L。
解析:(1)因为是一元酸和一元碱等物质的量浓度等体积混合,说明恰好完全反应,生成的产物是NaA,对NaA溶液分析,若a=7,说明HA是强酸,若a>7,说明溶液是因为A-的水解而显碱性,则HA是弱酸。
(2)不一定等于0.2。当HA是强酸时等于0.2;当HA是弱酸时,大于0.2。因为pH=7,说明c(H+)=c(OH-),那么根据电荷守恒可知,一定有c(Na+)=c(A-)。
(3)由丙组实验数据可知,两溶液等体积等物质的量浓度混合后pH>7,说明A-水解,得到HA是弱酸,其他易推知。
(4)丁组实验中所得溶液的pH=9,说明溶液中c(H+)=10-9 mol·L-1,则由水电离产生的c(H+)+c(H+)=c(OH-)+c(A-),则c(Na+)-c(A-)=c(OH-)-c(H+)=(10-5-10-9)mol·L-1。
答案:(1)a=7时,HA是强酸,a>7时,HA是弱酸
(2)否 C
(3)弱 c(Na+)>c(OH-)>c(H+)
(4)10-5 10-5-10-9

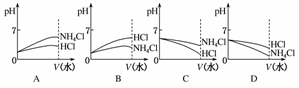
 (4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”,下同);混合前酸中的c(H+)和碱中的c(OH-)的关系为c(H+)________c(OH-);
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”,下同);混合前酸中的c(H+)和碱中的c(OH-)的关系为c(H+)________c(OH-);
 H++CO,K2=5.6×10-11;HClO
H++CO,K2=5.6×10-11;HClO