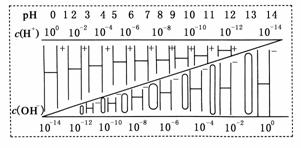
20.(1)在温度T下,某溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,该温度下水的离子积KW=__________;T__________(填“大于”“小于”或“等于”)25℃。
(2)常温下,向某Ba(OH)2溶液中逐滴加入pH=x的盐酸,测得如下数据:
|
序号 |
氢氧化钡的体积/mL |
盐酸的体积/mL |
溶液的pH |
|
① |
22.00 |
0.00 |
12 |
|
② |
22.00 |
18.00 |
11 |
|
③ |
22.00 |
22.00 |
7 |
x=__________,Ba(OH)2溶液的物质的量浓度为__________。
(3)常温下,向100 mL pH=2的硫酸与硫酸钠的混合溶液中,加入300 mL上述Ba(OH)2溶液,沉淀正好达最大量,此时溶液的pH__________(填“大于”“小于”或“等于”)7;原混合溶液中硫酸钠的物质的量浓度为__________________。
解析:(1)KW=c(H+)·c(OH-)=10-a×10-b=10-(a+b) =10-12>10-14,温度高于常温。
(2)根据数据①,c[Ba(OH)2]=10-2×mol·L-1=5×10-3 mol·L-1,根据数据③,盐酸c(H+)等于Ba(OH)2中c(OH-),为10-2mol·L-1,pH=2。
(3)混合溶液中加入Ba(OH)2,Ba(OH)2过量,溶液呈碱性。当沉淀正好达到最大量时,n(SO)=n(Ba2+),n(Na2SO4)=n[Ba(OH)2]-n(H2SO4)=5×10-3×0.3-0.01××0.1=0.001 mol,浓度为0.01 mol·L-1。答案:(1)1×10-12 大于 (2)2 5×10-3mol·L-1
(3)大于 0.01 mol·L-1

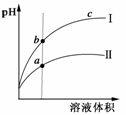 (2009·山东)某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡pH随溶液体积变化的曲线如右图所示。 ( )
(2009·山东)某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡pH随溶液体积变化的曲线如右图所示。 ( )