17.(12分)氢氧燃料电池是一种用氢气作为能源的电池。这种燃料电池的效率要比传统内燃机的效率高很多,所以燃料电池汽车(FCV)会有很高的效率。Schlesinger等人提出可用NaBH4与水反应制氢气: BH4-+2H2O=BO2-+4H2↑(反应实质为水电离出来的H+被还原)。该反应的产氢速率受外界条件影响。下表为pH和温度对NaBH4 半衰期的影响(半衰期是指反应过程中,某物质的浓度降低到初始浓度一半时所需的时间)。
|
体系 pH[ |
不同温度下NaBH4的半衰期(min) |
|||
|
0℃ |
25℃ |
50℃ |
75℃ |
|
|
8 |
4. 32 ×100 |
6. 19 ×10-1 |
8. 64 ×10-2 |
1.22
×10-2 |
|
10 |
4. 32 ×102 |
6. 19 ×101 |
8. 64 ×100 |
1.22
×100 |
|
12 |
4. 32 ×104 |
6. 19 ×103 |
8. 64 ×102 |
1.22
×102 |
|
14 |
4. 32 ×106 |
6. 19 ×105 |
8. 64 ×104 |
1.22
×104 |
根据要求回答下列问题:
(1)已知,NaBH4与水反应后所得溶液显碱性,则溶液中各离子浓度大小关系为_____________________。
(2)从上表可知,温度对NaBH4与水反应速率产生怎样的影响?
答: 。
(3)反应体系的pH为何会对NaBH4与水反应的反应速率产生影响?
答: 。
(4)实验表明,将NaBH4溶于足量水,释放的H2比理论产量少得多(即反应一段时间后有NaBH4剩余也不再反应)。其可能原因是 。
14.下列实验不能达到预期目的的是 ( )
|
序 号 |
实验操作 |
实验目的 |
|
A |
Cl2、Br2分别与H2反应 |
比较氯、溴的非金属性强弱 |
|
B |
MgCl2、AlCl3溶液中分别通入NH3 |
比较镁、铝的金属性强弱 |
|
C |
测定Na2CO3、Na2SO4两溶液的pH |
比较碳、硫的非金属性强弱 |
|
D |
用同一电路测定等浓度的盐酸、醋酸两溶液的导电性 |
比较盐酸、醋酸的相对强弱 |
12.X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法正确的是 ( )
|
X |
Y |
|
|
|
Z |
W |
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物酸性:Z>W>X
C.4种元素的氢化物中,Z氢化物最稳定
D.W单质与水反应,生成一种有漂白性物质
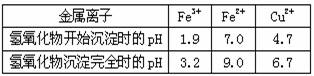
 (4)溶液中离子浓度是否还存在其他情况?如有,写出可能情况;如无,说明理由。
(4)溶液中离子浓度是否还存在其他情况?如有,写出可能情况;如无,说明理由。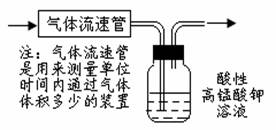 (12分)SO2、NOx是重要的空气污染源,必须经过处理后才能排放。一种工业尾气含SO2、O2、N2和CO2,某同学采用图示装置来测定该尾气中SO2的含量。
(12分)SO2、NOx是重要的空气污染源,必须经过处理后才能排放。一种工业尾气含SO2、O2、N2和CO2,某同学采用图示装置来测定该尾气中SO2的含量。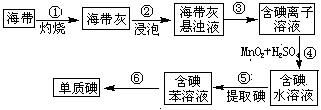 步骤④可用Cl2替代MnO2
步骤④可用Cl2替代MnO2 A.只用盐酸一种试剂就可以确定该固体M的具体成分
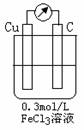
A.只用盐酸一种试剂就可以确定该固体M的具体成分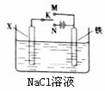 利用右图装置,可模拟铁的电化学防护。下列有关说法正确的是 ( )
利用右图装置,可模拟铁的电化学防护。下列有关说法正确的是 ( )