1.(2011朝阳区11.)常温下,有下列四种溶液:
|
① |
② |
③ |
④ |
|
0.1mol/L NaOH溶液 |
pH = 11 NaOH溶液 |
0.1mol/L CH3COOH溶液 |
pH = 3 CH3COOH溶液 |
下列说法正确的是
A.由水电离出的c(H+):①>③
B.③稀释到原来的100倍后,pH与④相同
C.①与③混合,若溶液pH = 7,则V(NaOH)>V(CH3COOH)
D.②与④混合,若溶液显酸性,则所得溶液中离子浓度可能为:
c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
6. (2011海淀0模26.)(17分)某校化学实验小组同学进行有关NO2气体的系列实验。
(2011海淀0模26.)(17分)某校化学实验小组同学进行有关NO2气体的系列实验。
(1)如右图所示,烧瓶中放有少量铜片,打开分液漏斗
的旋塞,加入过量浓硝酸,烧瓶中产生气体的颜色
是 ,试管中收集的气体颜色是 ,用化
学方程式表示其原因 ;
(2)反应结束后,夹住橡胶管,取出导管。若要使试管
中的气体尽可能多地转化为硝酸,简述实验方法:
;
(3)将烧瓶浸入冰水中,烧瓶内气体颜色 (填
“变深”、“不变”或“变浅”),使用化学用语和必要的文字说明颜色变化的原因 ;
(4)在80℃时,将0.40 mol N2O4气体充入2 L已经抽空的固定容积的密闭容器中发生反应,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4)/mol |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2)/mol |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
①计算a = ,此温度时该反应的平衡常数K= ;
②改变条件使反应重新达到平衡,能使c(NO2)/c(N2O4)值变小的措施有(填序号) 。
A.增大N2O4的起始浓度
B.升高温度
C.使用高效催化剂
D.向混合气体中通入稀有气体
答案.(17分)
(1)红棕色 …………………………………………………………………………1分
无色 …………………………………………………………………………1分
Cu + 4HNO3 (浓)==== Cu(NO3)2 + 2NO2↑ + 2H2O ………………………2分
3NO2 + H2O ==== 2HNO3 + NO …………………………………………………2分
(2)方法1:向试管中缓慢通入氧气,轻轻振动试管直到液面不再上升为止。
方法2:用塞子塞住试管口,取出试管。打开塞子,待气体变红棕色,塞好塞子,放入水槽中,打开塞子,反复多次上述操作。
(方法合理给分) ………………………………………………………………2分
(3)变浅 …………………………………………………………………………1分
2NO2  N2O4 ΔH<0 ,温度降低,平衡向正反应方向移动,c(NO2)浓度降低
N2O4 ΔH<0 ,温度降低,平衡向正反应方向移动,c(NO2)浓度降低
…………………………………………………………………………3分
(4)①a=0.28 ……………………………………………………………………2分
5.(石景山25.)(16分)工业合成氨与制备硝酸一般可连续生产,流程如下:
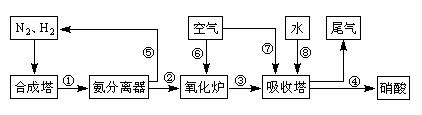
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____300℃(填“>”、“<”或“=”)。
2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____300℃(填“>”、“<”或“=”)。
|
T/℃ |
T1 |
300 |
T2 |
|
K |
1.00×107 |
2.45×105 |
1.88×103 |
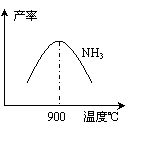 (3)N2和H2在铁作催化剂作用下从145℃就开始反应,
(3)N2和H2在铁作催化剂作用下从145℃就开始反应,
不同温度下NH3产率如图所示。温度高于900℃时,
NH3产率下降的原因 。
(4)在上述流程图中,氧化炉中发生反应的化学方程式为___________。
(5)硝酸厂的尾气直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H= -574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H= -1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:________________________。
(6)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式____________________,科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是__________(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为_______________________。
答案:25.(共16分,每空2分)
(1)1
(2)<
(3)温度高于900℃时,平衡向左移动。
(4)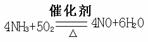
(5)CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g) △H=-867kJ/mol
(6)4NH3+3O2 点燃 2N2+6H2O;负极; 2NH3 - 6e- + 6OH- = N2 +6H2O
 2
mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为: c(B-)>c(H+)>c(Na+)>c(OH-)
2
mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为: c(B-)>c(H+)>c(Na+)>c(OH-) 4中,c(NH4+)由大到小的顺序是:②>①>
4中,c(NH4+)由大到小的顺序是:②>①> ④>③
④>③
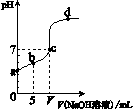 (211西城一模11.)向10.00 mL
0.01 mol/L某一元酸HA溶液中逐滴加入0.01 mol/L NaOH 溶液,溶液pH变化曲线如右图所示。下列说法不正确的是
(211西城一模11.)向10.00 mL
0.01 mol/L某一元酸HA溶液中逐滴加入0.01 mol/L NaOH 溶液,溶液pH变化曲线如右图所示。下列说法不正确的是