24.(8分)金属镁与镁合金在航空、汽车制造和电子工业等领域具有广泛的用途,金属镁的冶炼有多种方法,其中之一是以白云石(CaCO3·MgCO3)为原料,经高温煅烧生成氧化物(CaO·MgO),氧化物在还原炉中经1200℃真空条件下用硅铁还原生成镁蒸汽(铁在反应前后化合价不变),镁蒸汽经冷凝器冷凝为粗镁再经精炼、铸锭得到成品金属镁。反应工艺流程如下图:
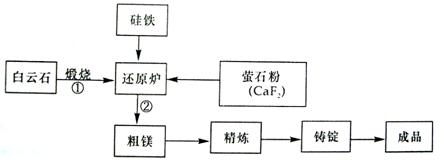
(1)若在实验室里煅烧白云石,可选择下列哪种坩埚?____________(填字母)
A.瓷坩埚 B.水晶坩埚 C.铁坩埚
(2)写出还原炉中硅铁还原氧化物的反应方程式
(3)在冶炼过程中反应温度对生成金属镁的影响如下图:
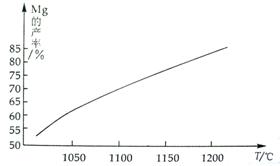
从图中可知,还原反应的反应热△H 0(填“>”、“<”),理由是
。
(4)还原炉中需要在1200℃真空条件下反应 ,反应达到平衡时的温度与压强的关系如下:
|
剩余压强/mmHg |
760 |
10 |
1 |
0.1 |
|
平衡时的温度/℃ |
2370 |
1700 |
1430 |
1235 |
真空条件对制备金属镁来说,可以达到的目的是
① ;②
23.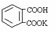 (10分)某学生用邻苯二甲酸氢钾
(相对分子质量为204.0)测定
(10分)某学生用邻苯二甲酸氢钾
(相对分子质量为204.0)测定
未知NaOH溶液的浓度,在本实验中达到滴定终点时,溶液的pH约为9.1。
(1)该学生用托盘天平称量时,先在两边托盘上放等质量的纸片,在左盘上放一个1g
的砝码,调整游码平衡时如下图所示。由此可知,所取邻苯二甲酸氢钾的质量为
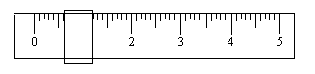 g。
g。
(2)将称好的邻苯二甲酸氢钾置于锥形瓶中,加适量蒸馏水完全溶解得到无色溶液,再加入1~2滴指示剂 (填“甲基橙”、“酚酞”或“石蕊”),当观察到
现象时,可停止滴定,记录数据。
(3)该学生进行了三次实验,所取固体均相同,所需未知氢氧化钠溶液的体积如下表:
|
实验编号 |
NaOH溶液的体积(mL) |
|
1 |
18.2 |
|
2 |
19.7 |
|
3 |
19.5 |
根据上述数据,你认为该学生是否有必要再重复实验获取更多数据?原因是
。
(4)若不再重复实验,利用上述数据计算得到的NaOH溶液的物质的量浓度为
mol / L(准确到小数点后两位)。
(5)以下操作会造成NaOH溶液计算结果偏大的是 (填序号)
①未用氢氧化钠溶液洗涤碱式滴定管
②滴定前平视,滴定后俯视
③滴定前滴定管尖嘴有气泡,滴定后气泡消失
④滴定前未用邻苯二甲酸氢钾溶液洗锥形瓶
21.(8分)酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及
印刷、纺织等工业。请根据要求回答下列问题:
(1)写出实验室制乙酸乙酯的化学方程式
(2) 欲提高乙酸的转化率,可采取的措施有 、 等
 (3)若用右图所示的装置来制备少量的乙酸乙酯,产率往往
(3)若用右图所示的装置来制备少量的乙酸乙酯,产率往往
偏低,其原因可能为: 、 等。
(4)此反应以浓硫酸作为催化剂,可能会造成产生大量酸性
废液、催化剂重复使用困难等问题。目前对该反应的催
化剂进行了新的探索,初步表明质子酸离子液体可作此
反应的催化剂,且能重复使用。实验数据如下表所示
(乙酸和乙醇以等物质的量混合)
|
同一反应时间 |
同一反应温度 |
||||
|
反应温度/℃ |
转化率(%) |
*选择性(%) |
反应时间/ h |
转化率(%) |
*选择性(%) |
|
40 |
77.8 |
100 |
2 |
80.2 |
100 |
|
60 |
92.3 |
100 |
3 |
87.7 |
100 |
|
80 |
92.6 |
100 |
4 |
92.3 |
100 |
|
120 |
94.5 |
98.7 |
6 |
93.0 |
100 |
|
*选择性100%表示反应生成的产物是乙酸乙酯和水 |
①根据表中数据,下列 (填字母)为该反应的最佳条件
A. 120℃,4h B. 80℃,2h C. 60℃,4h D. 40℃,3h
②当反应温度达到120℃时,反应选择性降低的原因可能是____________________。
 高温高压和使用催化剂的条件下,在密闭容器中发生如下反应:CO(g)+2H2(g)
高温高压和使用催化剂的条件下,在密闭容器中发生如下反应:CO(g)+2H2(g)