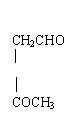4. 有四组同族元素的物质,在101.3 kPa时测定它们的沸点(℃)如下表所示:
|
第一组 |
He -268.8 |
(a) -249.5 |
Ar -185.8 |
Kr -151.7 |
|
第二组 |
F2 -187.0 |
Cl2 -33.6 |
(b) 58.7 |
I2
184.0 |
|
第三组 |
(c) 19.4 |
HCl -84.0 |
HBr -67.0 |
HI -35.3 |
|
第四组 |
H2O 100.0 |
H2S -60.2 |
(d) -42.0 |
H2Te -1.8 |
下列各项中正确的是
A.a、b、c的化学式分别为Ne2、Br2、HF
B.第二组物质只表现氧化性,不表现还原性
C.第三组物质对应水溶液均是强酸
D.第四组中各化合物的稳定性顺序为:H2O>H2S> H2Se>H2Te
29.(10分)a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
|
粒子代码 |
a |
b |
c |
d |
e |
f |
g |
|
原子核数 |
单核 |
单核 |
双核 |
多核 |
单核 |
多核 |
多核 |
|
电荷数 (单位电荷) |
0 |
+1 |
-1 |
0 |
+2 |
+1 |
0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。试写出:
(1) a粒子的核外电子排布式 。
(2) b与e相应元素的最高价氧化物对应水化物的碱性比较为: > (用化学式表示)。
(3) d粒子所构成的物质具有易液化的特性,推测其原因为: 。
(4) g粒子所构成的晶体类型属于 晶体。
(5) c粒子是 ,f粒子是 (用化学式表示)。
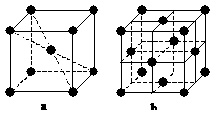 在1183 K以下纯铁晶体的基本结构单元如a所示,在1183 K以上转变为b所示结构的基本结构单元,在两种晶体中最邻近的铁原子间距离相同。下列说法正确的是
在1183 K以下纯铁晶体的基本结构单元如a所示,在1183 K以上转变为b所示结构的基本结构单元,在两种晶体中最邻近的铁原子间距离相同。下列说法正确的是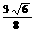
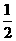 O2
(g) = H2O (1)
△H2
O2
(g) = H2O (1)
△H2 “纳米车”可以用来运输单个的有机分子,生产复杂的材料和药物,成为“纳米生产”中的有用工具。下列说法正确的是
“纳米车”可以用来运输单个的有机分子,生产复杂的材料和药物,成为“纳米生产”中的有用工具。下列说法正确的是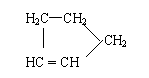
 由题中所给的信息Ⅰ、Ⅱ,结合已学知识,回答下列问题:
由题中所给的信息Ⅰ、Ⅱ,结合已学知识,回答下列问题: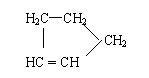 Ⅰ:
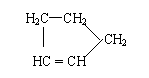
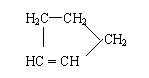
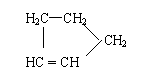
是环戊烯的结构简式,可进一步简写为 。
Ⅰ:
是环戊烯的结构简式,可进一步简写为 。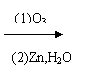 Ⅱ:有机物中烯键可发生如下反应:
Ⅱ:有机物中烯键可发生如下反应: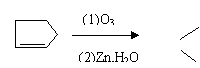 ① (CH3)2C=CHCH3
(CH3)2C=O +
CH3CH=O
① (CH3)2C=CHCH3
(CH3)2C=O +
CH3CH=O (1)写出异戊二烯(CH2=CH-C=CH2)经O3分解生成的各种产物的结构简式及物质
(1)写出异戊二烯(CH2=CH-C=CH2)经O3分解生成的各种产物的结构简式及物质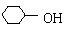
 (2)写出由环己醇( )合成己二醛(
)各步反应的化学
(2)写出由环己醇( )合成己二醛(
)各步反应的化学