18.(8分)(1)安全教育是化学教育的重要内容。根据你掌握的知识判断,下列各项中,符合安全操作要求的是 (填写序号)。
①在加油站内拨打手机
②在煤矿巷道内用明火照明
③闻氯气的气味时,用手轻轻在瓶口扇动,仅使极少量的氯气飘进鼻孔
④为了节约药品,锌与稀硫酸一开始反应,就做氢气点燃实验
⑤稀释浓硫酸时,沿烧杯内壁将浓硫酸缓缓加入水中,边加边搅拌
(2)下图为常见仪器的部分结构(有的仪器被放大)

A图中液面所示溶液的体积为 mL,C图中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时讯数为N mL,仰视时读数为M mL,若M>N,则所使用的仪器是 (填仪器序号字母)。
(3)粗盐经提纯后得到NaCl溶液,再经蒸发、结晶、烘干得精盐。
①蒸发操作中使用到的瓷质仪器的名称为 。
②该同学将所得精盐配成溶液,用于另一实验。实验中需要用100ml 1mol·L-1的NaCl溶液,配制过程中需用托盘天平称取的精盐质量为 g,用于定容的玻璃仪器的规格和名称 。
 19.(12分)某研究性学习小组为证明在相同条件下,同浓度同体积强弱不同的一元酸与同一种金属反应时,生成氢气的速率不同,同时测定该温度和压强下的气体摩尔体积,设计组装了两套如下图所示的简易实验装置。该实验的主要操作步骤如下:
19.(12分)某研究性学习小组为证明在相同条件下,同浓度同体积强弱不同的一元酸与同一种金属反应时,生成氢气的速率不同,同时测定该温度和压强下的气体摩尔体积,设计组装了两套如下图所示的简易实验装置。该实验的主要操作步骤如下:
①配制浓度均为1 mol·L-1的盐酸和醋酸溶液;
②在广口瓶乙中装水,按图示连接好装置,检查装置的气密性;
③量取10.00 mL 1mol·L-1的盐酸和醋酸溶液分别加入两套装置的锥形瓶中;
④称取两份质量均为a g的镁带(除去表面氧化膜、表面积相同),并固定于塑料杆末端;
⑤同时将塑料杆向下移动,使镁带浸入酸中至反应完全。
⑥反应结束后待温度恢复到室温,读出量筒中水的体积为V mL。
请根据上述步骤回答下列问题:
(1)用文字表述步骤②中检查该装置气密性的方法: 。
(2)量取10.00mL 1 mol·L-1盐酸和醋酸溶液分别注入锥形瓶中时,所用的仪器是
(填下列各项序号字母)
A.50mL量筒 B.10mL量筒
C.25 mL酸式滴定管 D.25 mL碱式滴定管
(3)步骤④中,理论上称取的镁带质量不能少于 g。
(4)步骤⑤中需记录的数据是 ;实验过程中观察到的主要现象是
。
(5)步骤⑥中,读取量筒中水的体积时若俯视读数,对计算该条件下的气体摩尔体积影响为 (填“偏大”、“偏小”或“无法确定”)
(6)为保证实验顺利进行,仪器丙应选用的规格是 (填序号字母)。
A.100mL B.200mL C.500mL
(7)若水蒸气的挥发影响忽略不计,在该温度和压强下,气体摩尔体积为 L·mol-1。
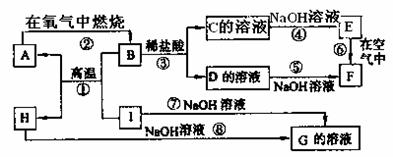 20.(9分)A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为主族元素的固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。
20.(9分)A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为主族元素的固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在元素周期表中位置 。
(2)写出C、H物质的化学式:C ,H 。
(3)写出反应①、⑦的化学方程式:
反应①: 。
反应⑦: 。
(4)反应⑥过程中的现象是 。
 21.(10分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
21.(10分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)右图是N2和H2反应生成2molNH3过程中能
量变化示意图,请计算每生成1molNH3放
出热量为 。
(2)在定体积的密闭容器中,进行如下化学反应:
 N2(g)+3H2(g) 2NH3(g),其化学平衡
N2(g)+3H2(g) 2NH3(g),其化学平衡
常数K与t的关系如下表:
|
t/K |
298 |
398 |
498 |
…… |
|
K/(mol·L-1)-2 |
4.1×106 |
K1 |
K2 |
…… |
请完成下列问题:
①试比较K1、K2的大小,K1 K2(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母)。
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.2v(N2)(正) = v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式 。
②盐酸肼水溶液中离子浓度的关系表示正确的是 (填序号)。
A.c(Cl-)>c(N2H2+6)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5·H2O]+)>c(OH-)>c(H+)
C.2 c(N2H2+6)+c([N2H5·H2O]+)+ c(H+) = c(Cl-)+c(OH-)
D.c(N2H2+6) > c(Cl-)> c(H+) >c(OH-)
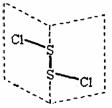 7.二氧化碳硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如右下图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是
7.二氧化碳硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如右下图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是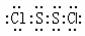
 B.Na2S的电子式:
B.Na2S的电子式:
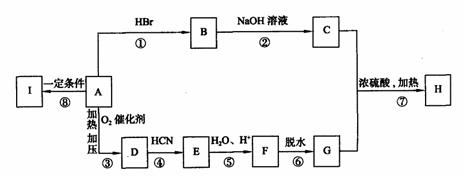 下列框图表示A、B、C、D、E、F、G、H、I各物质间的转化关系,已知有机物H分子中含有5个碳原子。有机物I是一种高分子材料。
下列框图表示A、B、C、D、E、F、G、H、I各物质间的转化关系,已知有机物H分子中含有5个碳原子。有机物I是一种高分子材料。