19.(10分)大城市机动车带来的污染问题不容忽视。汽车排出尾气中含有CO、NOx和其他大气污染物,其成分与车速有关。下面是不同车速时排放的污染物质量(以平均行驶1km算);
|
车速(km/h) |
CO/g |
NOx/g |
碳氢化合物/g |
|
50 |
8.7 |
0.6 |
0.6 |
|
80 |
5.4 |
1.5 |
0.7 |
|
120 |
9.6 |
3.8 |
0.8 |
(1)随着汽车速度增加,污染气体排放量随之增加最多的是 。
(2)在汽车尾气系统中装置催化转化器,可使尾气中的CO和NOx在催化剂作用下相互发生氧化还原反应转化成两种无毒的气体,从而有效减少尾气中大气污染物。
该反应的化学方程式为 。
(3)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数
(4)随着我国家用汽车数量的迅猛增加,不但中速了城市空气污染,而且加剧了能源危机,导致石油和石油产品的价格不断攀升。往汽油中混入比例达到20%至35%的酒精,不仅可以节约汽油,而且可以减少70%以上的污染。已知酒精的燃烧热为1367kJ,请写出酒精燃烧的热化学方程式:
。
17.(10分)工业上制备氯化铜时,是将浓盐酸用水蒸汽加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO + 2HCl = CuCl2 + H2O ,FeO + 2HCl = FeCl2 + H2O。
已知:
|
物质 |
开始沉淀时的pH |
|
||
|
Fe(OH)3 |
1.9 |
3.2 |
||
|
Fe(OH)2 |
7.0 |
9.0 |
||
|
Cu(OH)2 |
4.7 |
6.7 |
(1)若提供的药品有:Cl2、浓H2SO4、NaOH溶液、CuO、Cu,试结合题给表格请参照,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
_____________________________________________________________________。
(2)将除去Fe2+后所得溶液小心加热浓缩,再冷却结晶,即可得CuCl2·xH2O。
①过滤操作中需要的玻璃仪器有________________________________________。
②经检测,CuCl2·xH2O中含水28.6%,则CuCl2·xH2O中x的值为 。
③如果要将CuCl2·xH2O处理为无水氯化铜,如何操作:
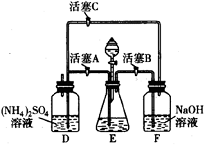 。
。
16.下述实验能达到预期目的的是 ( )
|
编号 |
实验内容 |
实验目的 |
|
A |
将SO2通入酸性KMnO4溶液中 |
证明SO2具有漂白性 |
|
B |
将Cl2通入NaBr溶液中 |
比较氯与溴的氧化性强弱 |
|
C |
将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 |
研究温度对化学平衡的影响 |
|
D |
向某无色溶液中滴加酚酞试液 |
确定该溶液为碱溶液 |
|
15.已知酸性条件下有如下反应:2Cu+=Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下 ( )
|
加入试剂 |
稀硫酸 |
浓硫酸、加热 |
稀硝酸 |
浓硝酸 |
|
实验现象 |
红色固体 和蓝色溶液 |
无色气体 |
无色气体 和蓝色溶液 |
红棕色气体 和绿色溶液 |
由此推出本次氢气还原氧化铜实验的产物是
A.Cu B.Cu2O
C.一定有Cu,可能有Cu2O D.一定有Cu2O,可能有Cu
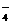 +_____Fe2++_____H+=_____Fe3++______Mn2++______H2O
+_____Fe2++_____H+=_____Fe3++______Mn2++______H2O