0 38646 38654 38660 38664 38670 38672 38676 38682 38684 38690 38696 38700 38702 38706 38712 38714 38720 38724 38726 38730 38732 38736 38738 38740 38741 38742 38744 38745 38746 38748 38750 38754 38756 38760 38762 38766 38772 38774 38780 38784 38786 38790 38796 38802 38804 38810 38814 38816 38822 38826 38832 38840 447348
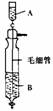 A.A中装浓硫酸,B中装浓盐酸
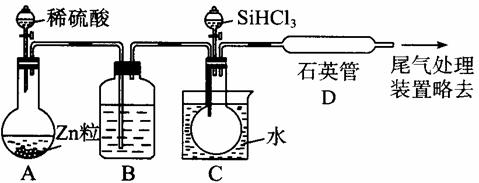
A.A中装浓硫酸,B中装浓盐酸 ①高温下用碳还原二氧化硅制得粗硅
①高温下用碳还原二氧化硅制得粗硅