24-A.(8分)物质结构与性质
 (1)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表
(填元素符号);其中电负性最大的是
(填右图中的序号)。
(1)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表
(填元素符号);其中电负性最大的是
(填右图中的序号)。
(2)请写出比元素1的原子序数大8的元素的基态原子电子排布式 。
(3)元素7的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。


若已知7的原子半径为d,NA代表阿伏加德罗常数,7的相对原子质量为M,请回答:
①晶胞中7原子的配位数为___ ___ _ ,一个晶胞中7原子的数目为_ _;
②该晶体的密度为______ _ (用字母表示)。
24-B.(8分)实验化学
工业上制备氯化铜时,是将浓盐酸用水蒸汽加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO + 2HCl = CuCl2 + H2O ,FeO + 2HCl = FeCl2 + H2O。
已知:
|
物质 |
开始沉淀时的pH |
|
||
|
Fe(OH)3 |
1.9 |
3.2 |
||
|
Fe(OH)2 |
7.0 |
9.0 |
||
|
Cu(OH)2 |
4.7 |
6.7 |
(1)若提供的药品有:Cl2、浓H2SO4、NaOH溶液、CuO、Cu,试结合题给表格请参照,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
________________________________________________________________。
(2)将除去Fe2+后所得溶液小心加热浓缩,再冷却结晶,即可得CuCl2·xH2O。
①过滤操作中需要的玻璃仪器有________________________________________。
②经检测,CuCl2·xH2O中含水28.6%,则CuCl2·xH2O中x的值为 。
③如果要将CuCl2·xH2O处理为无水氯化铜,如何操作:
 环扁桃醋具有松弛血管平滑肌,扩张血管的功能,其结构简式如下图。下列对该物质叙述中,正确的是
环扁桃醋具有松弛血管平滑肌,扩张血管的功能,其结构简式如下图。下列对该物质叙述中,正确的是 
 A.Janusene的分子式为C30H20
A.Janusene的分子式为C30H20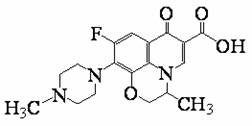 A.能发生加成、取代反应
A.能发生加成、取代反应