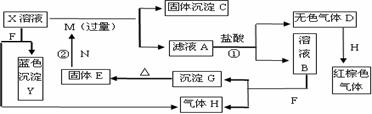
0 38382 38390 38396 38400 38406 38408 38412 38418 38420 38426 38432 38436 38438 38442 38448 38450 38456 38460 38462 38466 38468 38472 38474 38476 38477 38478 38480 38481 38482 38484 38486 38490 38492 38496 38498 38502 38508 38510 38516 38520 38522 38526 38532 38538 38540 38546 38550 38552 38558 38562 38568 38576 447348
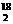 O和H
O和H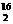 O都互为同素异形体
O都互为同素异形体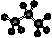 下列化学用语表达正确的是
下列化学用语表达正确的是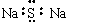 B.Na2S的电子式:
B.Na2S的电子式: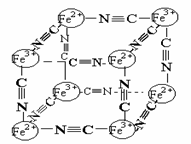 21A.(1)(2分)分析化学中常用X射线研究晶体结构.有一种蓝色晶体{可表示为:MxFey(CN)Z
},研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的点, 自身互不相邻,而CN-位于立方体的棱上.其晶体中的部分离子的空间结构关系如图示,下列说法正确的是( )
21A.(1)(2分)分析化学中常用X射线研究晶体结构.有一种蓝色晶体{可表示为:MxFey(CN)Z
},研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的点, 自身互不相邻,而CN-位于立方体的棱上.其晶体中的部分离子的空间结构关系如图示,下列说法正确的是( )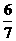 体积的NOx刚好完全反应,则x值为
。
体积的NOx刚好完全反应,则x值为
。
 ②R-Cl+CN-
R-CN+Cl-(R为烃基)。
②R-Cl+CN-
R-CN+Cl-(R为烃基)。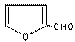 玉米芯、甘蔗渣等废物水解发酵后可制得糠醛
,它是重要的化工原料,它在一定条件下可发生以下变化:
玉米芯、甘蔗渣等废物水解发酵后可制得糠醛
,它是重要的化工原料,它在一定条件下可发生以下变化: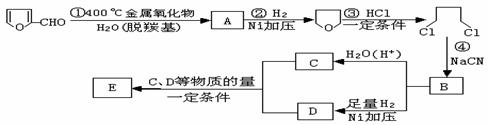
 CH3OH(g)。根据题意完成下列各题:
CH3OH(g)。根据题意完成下列各题: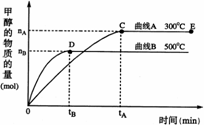 (1)反应达到平衡时,平衡常数表达式K= ,
(1)反应达到平衡时,平衡常数表达式K= ,