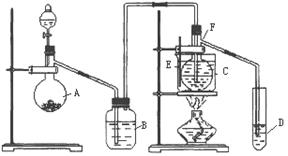
26.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA物质的量浓度(mol/L) |
NaOH物质的量浓度(mol/L) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
c1 |
0.2 |
pH=7 |
|
丙 |
0.2 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=9 |
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸 。
(2)不考虑其它组的实验结果,单从乙组情况分析,c1 (填“一定”或“不一定”)等于0.2mol/L,混合溶液中离子浓度c(A-)与c(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是 酸(填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是 。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)= mol/L,写出该混合溶液中下列算式的精确结果(不能做近似计算): c(Na+)-c(A-)= mol/L。
25.已知N2O4 和NO2在一定条件下存在如下平衡: -Q(Q>0)。100℃时,将0.200mol的四氧化二氮气体充入2L的密闭容器中,在不同时间对该容器内的物质进行测定,得到如下数据:
-Q(Q>0)。100℃时,将0.200mol的四氧化二氮气体充入2L的密闭容器中,在不同时间对该容器内的物质进行测定,得到如下数据:
|
时间(s) 浓度(mol/L) |
0 |
20 |
40 |
60 |
80 |
100 |
|
c(N2O4) |
0.100 |
c1 |
0.050 |
c3 |
a |
b |
|
c(NO2) |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
0.120 |
试填空:
(1)该反应的平衡常数表达式为K= ,
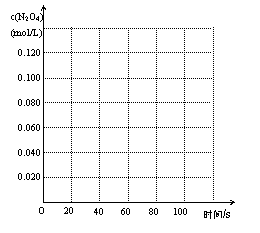 表中c1= ,c2=
;a b(填“=”,“>”或“<”)。
表中c1= ,c2=
;a b(填“=”,“>”或“<”)。
(2)在0-20s内,四氧化二氮的平均反应速率
为 。
(3)请在右边的坐标图中画出四氧化二氮的
浓度随时间变化的曲线图。
(4)若要测定NO2气体的相对分子质量,
在下列条件下测定时可以减小误差的是 。
A.升高温度 B.降低温度
C.增大压强 D.减小压强
24.一定温度下,当弱酸在溶液中达到电离平衡时,各微粒的浓度存在一种定量的关系。若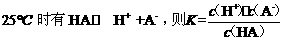 。式中:K为电离平衡常数,只与温度有关,c为各微粒在达到平衡时的浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
。式中:K为电离平衡常数,只与温度有关,c为各微粒在达到平衡时的浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
|
酸 |
电离方程式 |
电离平衡常数K |
|
CH3COOH |
CH3COOH CH3COO-+H+ CH3COO-+H+ |
1.76×10-5 |
|
H2CO3 |
H2CO3 H++HCO3- H++HCO3-HCO3-  H++CO32- H++CO32- |
K1==4.31×10-7 K2==5.61×10-11 |
|
H2S |
H2S H++HS- H++HS-HS-  H++S2- H++S2- |
K1==9.1×10-8 K2==1.1×10-12 |
回答下列各题:
(1)K只与温度有关,温度升高时, (填“促进”或“抑制”)弱酸的电离,K值 (填“增大”、“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱关系是 。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-都看作是酸,其中酸性最强的是 ,最弱的是 。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2之间存在一定关系,此关系是 ,由此关系可看出多元弱酸的酸性主要由第 步电离决定。
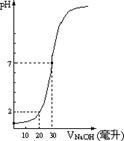 下图为10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,试计算:
下图为10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,试计算: (2) 盐酸X的物质的量浓度为多少?
(2) 盐酸X的物质的量浓度为多少?

 )与苯炔(
)与苯炔( )反应生成化合物X(X结构中三个苯环呈立体对称结构),如下图:
)反应生成化合物X(X结构中三个苯环呈立体对称结构),如下图: