摘要:21A.分析化学中常用X射线研究晶体结构.有一种蓝色晶体{可表示为:MxFey(CN)Z },研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的点, 自身互不相邻.而CN-位于立方体的棱上.其晶体中的部分离子的空间结构关系如图示.下列说法正确的是( ) A.该晶体属于原子晶体 B.该晶体化学式MFe2(CN)6 C.M的离子位于上述立方体的体心.呈+1价 D.该晶体属于离子晶体.M呈+2价 C.Si.Ge.Sn是同族元素.该族元素单质及其化合物在材料.医药等方面有重要应用.请回答下列问题: 1) Ge的原子核外电子排布式为 2) C.Si.Sn三种元素的单质中.能够形成金属晶体的是 3) 按要求指出下列氧化物的空间构型.成键方式或性质 ①CO2分子的空间构型及碳氧之间的成键方式 , ②SiO2晶体的空间构型及硅氧之间的成键方式 , ③已知SnO2是离子晶体.写出其主要物理性质 4) CO可以和很多金属形成配合物.如Ni(CO)4.Ni与CO之间的键型为 5) 碳氧键的红外伸缩振动频率与键的强度成正比.已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm-1.CO分子中碳氧键的伸缩振动频率为2143cm-1.则Ni(CO)4中碳氧键的强度比CO分子中碳氧键的强度 A.强 B.弱 C.相等 D.无法判断 21B.某化学研究性学习小组探讨Fe3+和SO32-之间发生怎样的反应.请你一起参与并协助他们完成实验. (1)提出猜想: 甲同学认为发生双水解反应:Fe3++ SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3 乙同学认为发生氧化还原反应.其反应方程式为 (2)实验验证:丙同学设计了下列实验来探究反应的可能性. ①为了检验所用的Na2SO3是否变质.应选用的试剂是 ②取5mLFeCl3溶液于试管中.逐滴加入Na2SO3溶液至过量.观察到溶液颜色由黄色变为红棕色(无气泡产生.也无沉淀生成) ③将②溶液分成两等份.其中一份加入稀盐酸至过量.再加入BaCl2稀溶液.有白色沉淀生成,另一份滴入几滴KSCN溶液.溶液变为血红色 (3)得出结论: ①根据丙同学的实验得出的结论是: ②实验③中溶液变成血红色的离子方程式为 (4)拓展探究: 丁同学在FeCl3溶液中加入Na2CO3溶液.观察到红褐色沉淀并且产生无色气体.从形式上看.Na2CO3 和Na2SO3相似.但二者的水溶液与氯化铁溶液反应的现象差别很大.其原因是 08届高三第一学期期末模拟考试
网址:http://m.1010jiajiao.com/timu3_id_384795[举报]
已知Fe2O3在高炉中有下列反应:Fe2O3+CO→2FeO+CO2
反应形成的固体混和物(Fe2O3、FeO)中,元素铁和氧的质量比用 mFemO表示。
(1)上述固体混和物中,mFemO不可能是 (选填 a、b、c多选扣分)
(a)219 (b)217.5 (c) 216
(2)若mFemO=218,计算Fe2O3被CO还原的百分率
(3)设 Fe2O3被CO还原的百分率为A%,则A%和混和物中mFemO的关系式为(用含mFe、mO的代数式表示)。
A%=
请在下图中画出A%和mFe/mO关系的图形。
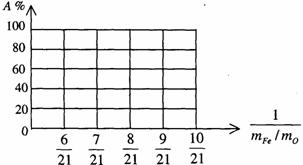
(4)如果 Fe2O3和CO的反应分两步进行:
3Fe2O3+CO→2Fe3O4+CO2
Fe3O4+CO→3FeO+CO2
试分析反应形成的固体混和物可能的组成及相应的mFemO(令mFemO=21a,写出a的取值范围)。将结果填入下表。
| 混和物组成(用化学式表示) | a的取植范围 |