2、 阿伏加德罗定律及推论
|
条件 |
结论 |
文字 |
|
T、P相同 |
 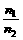 = =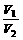 |
同温同压下,气体的分子数与其体积成正比 |
|
T、V相同 |
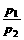 = =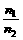 |
温度、体积相同的气体,压强与其分子数成正比 |
|
T、P相同 |
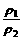 = = |
同温同压下,气体的密度与其相对分子质量成正比 |
|
T、P、V相同 |
 = =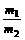 |
同温同压下,体积相同的气体,相对分子质量与其质量成正比 |
|
T、P、m相同 |
 = =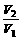 |
同温同压下,等质量的气体相对分子质量与其体积成反比 |
 2AlN+3CO,由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品有关成分的含量,进行了以下两个实验:
2AlN+3CO,由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品有关成分的含量,进行了以下两个实验: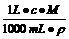 直接计算。
直接计算。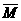 ,
,