7、实验室利用反应:Na2S2O3+H2SO4====Na2SO4+S↓+SO2↑+H2O,以溶液变浑浊时间的长短来研究影响化学反应速率的因素,下列各组实验中化学反应速率最大的是
组号反应
|
组号 |
反应 温度 (℃) |
参加反应的物质 |
||||
|
Na2S2O3 |
H2SO4 |
H2O的 体积(mL) |
||||
|
体积(mL) |
浓度(mol·L-1) |
体积(mL) |
浓度(mol·L-1) |
|||
|
A |
10 |
5.0 |
0.10 |
10.0 |
0.10 |
5.0 |
|
B |
10 |
5.0 |
0.10 |
5.0 |
0.10 |
10.0 |
|
C |
30 |
5.0 |
0.10 |
5.0 |
0.10 |
10.0 |
|
D |
30 |
5.0 |
0.20 |
5.0 |
0.10 |
10.0 |
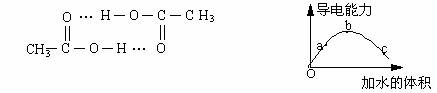
 H3O+ +CH3COO
-
H3O+ +CH3COO
- 3Cl2↑+3K2SO4+3H2O,如果原KClO3为A mol,
3Cl2↑+3K2SO4+3H2O,如果原KClO3为A mol,